Système Lewis : les anticorps anti-Lewis
Auteures : Sophia Peng, M.D., FRCPC; Danielle Meunier, M.D., FRCPC
Publication : Octobre 2019
Public cible : Technologues de laboratoire médical hospitalier, spécialistes en médecine transfusionnelle
À retenir
- Les anticorps anti-Lewis n’ont pas d’importance clinique.
- Les patients possédant des anticorps anti-Lewis doivent recevoir des unités de CGR compatibilisé (test indirect à l’antiglobuline à 37 °C).
- Les patients atteints d’anémie falciforme (drépanocytose) possédant des anticorps anti-Lewis doivent recevoir des unités de CGR dépourvu des antigènes associés.
Introduction
Les anticorps anti-Lewis – anti-Lea, anti-Leb et anti-Leab – sont des anticorps dirigés contre les antigènes Lewis. Ces antigènes sont des glycoprotéines que l’on retrouve à la surface de plusieurs types de cellules et qui sont sécrétées dans divers liquides biologiques. Parce que les antigènes Lewis se retrouvent dans différents types de tissus, ils sont considérés comme un groupe histosanguin, au même titre que le système ABO et l’antigène H. Ces antigènes circulants sont adsorbés par les globules rouges sur leur membrane. À l’instar du système ABO, l’oligosaccharide précurseur du système Lewis peut être facilement modifié par une enzyme fucosyltransférase autosomique dominante (FUT3), comme cela est illustré dans le schéma ci‑dessous. La combinaison du gène Lewis (FUT3) et du gène sécréteur (FUT2) donne trois phénotypes principaux : Le(a), Le(b) et Le(a-b-). Le phénotype Le(a+b+), également possible, concerne généralement les personnes originaires de l’Asie orientale qui présentent un phénotype sécréteur faible.
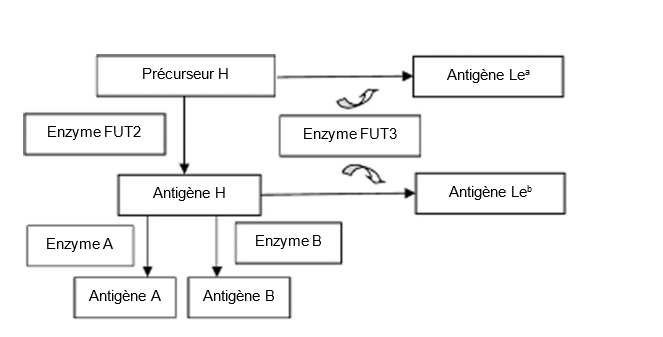
Image : Hu D, et coll. Gastroenterology. 2014;29(10):1778-85.
Figure 1 : Schéma simplifié de la relation entre le système Lewis, le système ABO et l’antigène H. Chez les non sécréteurs (absence de l’enzyme FUT2), l’antigène Lea se forme par ajout d’un résidu de fucose au précurseur H. Chez les sécréteurs (présence de l’enzyme FUT2 active), l’antigène H contenu dans les sécrétions est modifié par l’enzyme FUT3 pour former l’antigène Leb. Les personnes possédant un phénotype Le(a-b-) ne possèdent pas d’enzyme FUT3 active, et peuvent être de type sécréteur ou non sécréteur – en fonction de l’enzyme FUT2 – sans que cela se reflète au niveau du phénotype.
Les anticorps anti-Lea, anti-Leb et anti-Leab sont relativement communs. Ils sont en général naturellement présents dans l’organisme – c’est-à-dire que leur présence n’est pas due à une exposition à des hématies dans le cadre d’une transfusion ou d’une grossesse –, mais peuvent également être stimulés. Qu’ils soient naturels ou non, il s’agit principalement d’anticorps de type IgM associés à du matériel IgG, que l’on retrouve le plus souvent chez les personnes présentant un phénotype Lewis négatif ou Le(a-b-). Dans de très rares cas, l’anti-Lea peut correspondre à un anticorps de type IgG pur.
Analyses prétransfusionnelles
Dans un contexte transfusionnel, les anticorps anti-Lea, anti-Leb et anti-Leab n’ont presque jamais d’importance clinique. Dans de rares cas, l’anti-Lea – le plus souvent – a été associé à des réactions transfusionnelles hémolytiques. Ce qui peut être dû à trois phénomènes : 1) en raison de la prédominance des IgM, les anticorps sont généralement inactifs à la température du corps, 2) comme l’antigène est beaucoup sécrété, les antigènes présents dans le plasma du donneur neutralisent les anticorps du receveur et 3) les cellules transfusées se débarrassent facilement de leur antigène, ce qui fait que les antigènes membranaires du donneur correspondent au phénotype du receveur.
En général, les anticorps anti-Lea, anti-Leb et anti-Leab ne sont pas associés à la maladie hémolytique du fœtus et du nouveau-né. Ils sont souvent détectés dans le sérum prénatal, car les femmes enceintes ont tendance à les perdre pendant la grossesse, ce qui leur confère un phénotype Le(a-b-) temporaire associé à la capacité de fabriquer des anti-Lea, des anti-Leb et des anti-Leab jusqu’au retour de leur phénotype normal, aux alentours de six semaines après l’accouchement. Toutefois, ces anticorps étant principalement de type IgM, ils ne traversent pas facilement la barrière placentaire. Enfin, bien que les antigènes Lewis puissent être présents dans le sérum des nouveau-nés, ils ne s’expriment pas à la surface des globules rouges du fœtus ou du nouveau-né.
Les anticorps anti-Lewis sont en général de type IgM. Ils sont habituellement plus réactifs à température ambiante (phase de centrifugation immédiate). Ils peuvent présenter un risque transfusionnel lorsqu’ils sont présents dans l’échantillon de sang prétransfusionnel d’un patient (test indirect à l’antiglobuline à 37 °C). Toutefois, il n’est pas nécessaire de transfuser du CGR dépourvu de l’antigène associé; il suffit de transfuser du CGR compatibilisé (test indirect à l’antiglobuline à 37 °C). Les recommandations en matière de transfusion de CGR pour les patients possédant des anticorps non ABO sont résumées dans le tableau 1.
Patients atteints d’anémie falciforme
S’agissant des patients atteints d’anémie falciforme ne possédant pas d’anticorps, la plupart des directives préconisent la transfusion d’unités de CGR Rh et K (KEL1) compatible. Pour ceux qui ont déjà possédé ou possèdent un ou plusieurs anticorps, il est souvent recommandé de transfuser du CGR ayant un phénotype et un génotype compatibles – Rh, K, Kidd et système sanguin Duffy, et antigènes S/s. En cas d’apparition d’un anti-Lea, d’un anti-Leb ou d’un anti-Leab chez un patient drépanocytaire, il convient de transfuser du CGR dépourvu de l’antigène associé et entièrement compatible avec les phénotypes Rh et Kell du patient. En effet, compte tenu des risques élevés d’hyperhémolyse chez ces patients, le CGR doit être entièrement compatible avec leurs profils antigènes et anticorps.
Associations avec d’autres maladies
- L’antigène Leb est un récepteur épithélial gastrique de Helicobacter pylori.
- Les antigènes Lewis s’expriment dans le tissu rénal, en particulier dans l’épithélium du tube distal et dans l’endothélium vasculaire. Bien que plusieurs études aient mis en cause les anticorps anti-Lewis dans l’échec d’allogreffes rénales chez des receveurs présentant un phénotype Le(a-b-), il n’y a pas suffisamment de données pour faire des antigènes Lewis des marqueurs d’histocompatibilité courants.
Tableau 1 : Transfusion de CGR pour les patients possédant des anticorps non ABO
|
Anticorps |
Recommandation* |
|---|---|
|
Système Diego |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
Système Kell |
|
|
CGR compatibilisé dépourvu de l’antigène Jsa (test indirect à l’antiglobuline à 37 °C) |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
Système Lewis |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
Système Lutheran |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
Système MNS |
|
|
CGR compatibilisé (test indirect à l’antiglobuline ou méthode équivalente utilisant un sérum antiglobuline humaine IgG) |
|
|
Rhésus |
|
|
CGR compatibilisé (test indirect à l’antiglobuline à 37 °C) |
|
|
CGR compatibilisé dépourvu de l’antigène V (test indirect à l’antiglobuline à 37 °C) |
|
*Les patients atteints d’anémie falciforme (drépanocytose) possédant un ou plusieurs de ces anticorps doivent recevoir des unités de CGR dépourvu du ou des antigènes associés.
Ressources complémentaires
Pour vous familiariser avec l’immuno-hématologie et les tests de compatibilité des banques de sang, consultez LearnSerology.ca, une ressource éducative en ligne conçue par des spécialistes canadiens de la médecine transfusionnelle. Le programme compte six modules, en plus d’un outil interactif qui permet d’effectuer une recherche d’anticorps à l’aide d’un panel d’échantillons.
Suggestion de citation
Peng S, Meunier D, « Système Lewis : les anticorps anti-Lewis », Ottawa, Société canadienne du sang, 9 octobre 2019. Consulté le [JJ mois AAAA]. Disponible sur le Web : https://profedu.blood.ca/fr/transfusion/best-practices/serological-best-practices/les-anticorps-anti-lewis
Ressources
1. Cooking L. Chapter 12: ABO, H, and Lewis Blood Groups and Structurally Related Antigens; The Lewis system. In: Fung M, Grossman B, Hillyer C, Westhoff C, editors. Technical Manual, 18th Ed. Bethesda: AABB; 2014. p. 304-6.
2. Reid M, Lomas Francis C and Olsson M. The Blood Group Antigens Facts Book. 3rd Ed. San Diego: Elsevier Science & Technology; 2012. Section II: The blood group systems and antigens; Lewis Blood Group System. p. 347-59.
3. Daniels G. Human Blood Groups 3rd ed. Oxford: Wiley-Blackwell; 2013. Chapter 2, ABO, H and Lewis Systems, 2.17: Lewis Antibodies. p. 60-62.
4. Milkens C, Berryman J, Cantwell C, et al. for BCSH. Guidelines for pre-transfusion compatibility procedures in blood transfusion laboratories. Transfus Med. 2012 Dec 06;23(1):1-71. Disponible sur le Web : https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-3148.2012.01199.x
5. Davis BA, Allard S, Qureshi A, et al. Guidelines on red cell transfusion in sickle cell disease. Part I: principles and laboratory aspects. Chest. 2012; 141(2_suppl):e152S-e184S. 2016 Nov 07;176(2):145-330. Disponible sur le Web : http://www.b-s-h.org.uk/guidelines/guidelines/red-cell-transfusion-in-sickle-cell-disease-part-l/
6. The Canadian Haemoglobinopathy Association. Transfusion. In: Consensus Statement on the Care of Patients with Sickle Cell disease in Canada. Version 2.0. Ottawa; 2018. p. 12-20. Available from: https://www.canhaem.org/wp-content/uploads/2018/05/Sickle-Cell-Consensus.pdf