Chapitre 1
Du donneur au receveur – un ouvrage sur l’activité transfusionnelle au Canada
Contexte
Un système du sang solide est indispensable au bon fonctionnement du système de soins de santé canadien. Il est nécessaire que les composants sanguins et les produits sanguins soient accessibles aux différents services de santé qui prolongent et améliorent la vie de nombreuses personnes chaque année (chirurgie, traitement des cancers et d’autres maladies aiguës ou chroniques, traumatologie, transplantation d’organes, accouchements).1
Lors de la tragédie du sang contaminé2 survenue dans les années 1980 et 1990, des milliers de Canadiens ont été infectés par le virus de l’immunodéficience humaine (VIH) et le virus de l’hépatite C (VHC). Cette tragédie a mené à la Commission d’enquête sur l’approvisionnement en sang au Canada. En 1997, le juge Krever a déposé à la Chambre des communes son rapport dans lequel il formulait 50 recommandations.3 Cette même année, les gouvernements fédéral, provinciaux et territoriaux (à l’exception du Québec) signaient un protocole d’entente décrivant le nouveau système national d’approvisionnement en sang, la fonction et la structure de l’autorité nationale du sang, ainsi que leur relation avec celle-ci.
En 1998, la Société canadienne du sang était créée à titre d’autorité nationale du sang. Assumant le rôle de membres de la Société, les ministères de la Santé des provinces et des territoires (à l’exception du Québec) ont été chargés de fournir la plupart des fonds et les gouvernements en sont devenus les bailleurs de fonds principaux. Le nouveau système allait bénéficier de l’appui de plusieurs comités de consultation et de liaison qui assureraient la communication entre les parties et l’implication du milieu médical ainsi que des communautés de receveurs et de donneurs.
Parallèlement, le gouvernement du Québec adoptait la Loi sur Héma-Québec et sur le Comité de biovigilance, L.R.Q., c H-1.1, créant Héma-Québec à titre d’autorité du sang pour la province du Québec. Cette loi instituait également un comité de biovigilance visant à informer le gouvernement québécois des risques liés au système du sang. Tant pour la Société canadienne du sang que pour Héma-Québec, le gouvernement fédéral est responsable de la supervision réglementaire de la collecte, du traitement, de l’analyse et de la distribution des composants sanguins (globules rouges, plaquettes, plasma destiné à la transfusion) et des produits sanguins (incluant une catégorie de médicaments appelés protéines plasmatiques et produits connexes) afin d’en garantir la qualité et l’innocuité.
Ce premier chapitre du Guide de la pratique transfusionnelle donne une vue d’ensemble du système d’approvisionnement en sang au Canada, et plus particulièrement des règlements et des normes en place ainsi que des organisations et des professionnels qui, combinés, veillent à un système du sang sûr, sans danger et durable pour la population canadienne.
Gouvernement fédéral
La qualité et l’innocuité des composants sanguins et des produits sanguins sont supervisées par le gouvernement canadien. En effet, les composants sanguins et les produits sanguins sont considérés comme des médicaments de l’annexe D en vertu de la Loi sur les aliments et drogues, L.R.C. (1985), ch. F-27. Pendant des dizaines d’années, la collecte, le traitement, l’analyse et la distribution des composants sanguins destinés à la transfusion et à la transformation ont été régis par le Règlement sur les aliments et drogues, C.R.C., ch. 870. En 1992, les Directives de la Direction des médicaments Blood Collection and Blood Component Manufacturing étaient publiés par Santé et Bien-être social Canada (le prédécesseur de Santé Canada), fournissant des standards de référence et définissant les critères minimaux pour les établissements responsables en matière de collecte et de préparation des composants sanguins en dehors du milieu hospitalier. En 1999, les Bonnes pratiques de fabrication des drogues visées à l’annexe D, partie 2, Sang et composants du sang humain étaient publiées par l’organisme de réglementation fédéral pour fournir aux établissements du sang des indications précises sur l’application des bonnes pratiques de fabrication. Ces lignes directrices ont été suivies par la Société canadienne du sang et Héma-Québec pendant de nombreuses années jusqu’à ce qu’elles soient abrogées. La préparation, l’importation et la vente en gros des produits sanguins (protéines plasmatiques et produits connexes) sont réglementées par le Règlement sur les aliments et drogues et sont soumises aux différentes lignes directrices de Santé Canada que suivent les fabricants, les importateurs et les grossistes (la Société canadienne du sang et Héma-Québec, entre autres).
L’Association canadienne de normalisation (aujourd’hui connue sous le nom de Groupe CSA) a publié la première édition de la Norme nationale du Canada sur le sang et les composants sanguins (Norme CSA sur le sang) en 2004.4,5 Cette norme traite des exigences en matière de gestion pour les établissements qui prélèvent, traitent, analysent, entreposent et utilisent les composants de sang humain à des fins de transfusion. Elle aborde les questions touchant l’innocuité, l’efficacité et la qualité de ces produits pour les receveurs, la sécurité des donneurs, la gestion des composants sanguins et la sécurité du personnel de l’établissement et de toute autre personne exposée à ces composants ou susceptible d’en subir les effets.4 Cette norme a été élaborée par un comité technique composé de professionnels de la santé et de représentants des gouvernements fédéral, provinciaux et territoriaux, des groupes d’utilisateurs et des établissements du sang. Pour ce faire, le comité technique a consulté les données factuelles nouvelles et les normes équivalentes au Canada et à l’étranger, y compris les Standards for Blood Banks and Transfusion Services de l’AABB (Association for the Advancement of Blood & Biotherapies) et les Normes pour services transfusionnels en milieu hospitalier de la Société canadienne de médecine transfusionnelle.
L’une des recommandations du juge Krever était de modifier la Loi sur les aliments et drogues pour clarifier la réglementation du sang. En 2014 est entré en vigueur le Règlement sur le sang, DORS/2013-178, accompagné d’une ligne directrice complémentaire.6 Le Règlement sur le sang s’applique au sang prélevé à des fins de transfusion ou de transformation en médicaments pour usage humain. Le Règlement sur le sang s’applique aux établissements qui prélèvent, traitent, étiquettent, entreposent, distribuent, importent ou transforment du sang à des fins de transfusion et aux établissements qui prélèvent du sang à des fins de transformation. Les fournisseurs de sang sont tenus de soumettre leurs changements opérationnels à Santé Canada et de démontrer que ces changements ne compromettent pas la sécurité des receveurs ni la suffisance de l’approvisionnement. Le Règlement sur le sang ne s’applique pas au sang de cordon ni aux cellules souches hématopoïétiques, lesquels sont réglementés par le Règlement sur la sécurité des cellules, tissus et organes humains destinés à la transplantation, DORS/2007-118, ni au sang destiné à des essais cliniques en vertu du Règlement sur les aliments et drogues, ni au sang importé pour être transformé en médicament pour usage humain.
Pour appuyer les activités de surveillance, l’Agence de la santé publique du Canada a mis sur pied le Programme de contributions pour la sûreté du sang, qui comprend le Système de surveillance des erreurs transfusionnelles et le Système de surveillance des incidents transfusionnels. Les informations recueillies par l’entremise de ces systèmes volontaires sont utilisées pour dégager les tendances dans les erreurs transfusionnelles, les effets indésirables et les incidents survenus dans les hôpitaux canadiens. Ces informations servent également de point de référence pour les parties prenantes à l’échelle nationale et internationale.7 En substance, ces systèmes visent à améliorer les pratiques transfusionnelles et à maximiser la sécurité des patients.
Gouvernements provinciaux et territoriaux
Au Canada, les gouvernements provinciaux et territoriaux (à l’exception du Québec) sont responsables du financement de la Société canadienne du sang, qui est leur fournisseur de sang. Les ministères de la Santé des provinces et des territoires (à l’exception du Québec) libèrent chaque année les fonds requis par la Société canadienne du sang pour fonctionner durant l’exercice financier correspondant. Ainsi, les hôpitaux de ces provinces et territoires ne paient pas directement les composants sanguins et les produits sanguins, chaque ministère de la Santé étant responsable du financement. Les fonds accordés à la Société canadienne du sang par chaque province ou territoire sont généralement fonction de leur utilisation des composants sanguins et des produits sanguins.
Les ministères de la Santé des provinces et des territoires (à l’exception du Québec) nomment les membres du conseil d’administration de la Société canadienne du sang, qui supervisent la Société canadienne du sang. Les ministères sont également représentés au comité de liaison provincial et territorial de la Société canadienne du sang et au Comité consultatif national sur le sang et les produits sanguins (CCN), dont les rôles sont les suivants :
- À titre d’intermédiaire entre la Société canadienne du sang et les provinces et territoires, le comité de liaison appuie la Société canadienne du sang dans son travail qui consiste à fournir à l’ensemble du pays (sauf au Québec) du sang et des produits sanguins sûrs, en quantité suffisante et à un prix abordable. Ce comité se compose de représentants de la Société canadienne du sang et de chaque ministère de la Santé provincial ou territorial.
- Le CCN est un organe consultatif qui conseille les ministères provinciaux et territoriaux de la Santé (à l’exception du Québec) ainsi que la Société canadienne du sang sur la gestion de l’utilisation rentable du sang et des produits sanguins, ainsi que sur les pratiques de médecine transfusionnelle. À la demande du comité de liaison, le CCN a rédigé une série de recommandations et de lignes directrices sur des sujets d’intérêt, comme la gestion de l’utilisation des composants sanguins et des produits sanguins en période de pénurie importante de sang. Le CCN comprend des professionnels de la santé nommés par les gouvernements provinciaux et territoriaux, des représentants de la Société canadienne du sang et un représentant du ministère de la Santé.
Plusieurs gouvernements provinciaux et territoriaux ont mis sur pied un programme de coordination du sang afin de guider et soutenir les autorités sanitaires régionales relevant de leur compétence. Les bureaux provinciaux de coordination du sang servent également d’intermédiaires entre les autorités sanitaires régionales et les gouvernements provinciaux relativement à la gestion des composants sanguins et des produits sanguins (voir les liens des sites Web des bureaux provinciaux de coordination du sang).
Fournisseurs de sang
Les fournisseurs de sang au Canada sont les suivants :
- Héma-Québec, pour la province du Québec;
- la Société canadienne du sang, pour les provinces et les territoires à l’exception du Québec;
- Grifols, autorisé depuis 2022 à œuvrer dans certaines régions du Canada pour prélever du plasma et fabriquer des produits plasmatiques purifiés à destination exclusive des patients au Canada.
Les fournisseurs de sang sont responsables du recrutement et de la sélection des donneurs, de la collecte, de l’analyse et du traitement des dons ainsi que de la fourniture du sang ou des produits sanguins aux établissements de santé.
Pour la Société canadienne du sang, l’appui d’un système et d’établissements de gestion de la qualité, couplé à du personnel qualifié ayant différentes compétences et expertises (soins médicaux, soins infirmiers, technologie de laboratoire, juridique, réglementation, finances, technologie de l’information, assurance de la qualité, sciences sociales, épidémiologie, marketing/recrutement, gestion de la chaîne d’approvisionnement) garantit un approvisionnement en composants sanguins et produits sanguins sûrs qui respectent les normes de qualité et de sécurité les plus élevées.
Sélection des donneurs
Comme l’indiquent les lignes directrices de l’Organisation mondiale de la Santé sur l’admissibilité au don de sang, « les services transfusionnels doivent recueillir le sang uniquement de donneurs qui posent un faible risque d’infection transmissible par transfusion et dont la santé risque peu d’être affectée par le don de sang. »8 La sélection des donneurs fait également partie des sujets abordés dans les normes4. Les fournisseurs de sang répondent aux exigences de la norme en suivant une procédure rigoureuse comportant plusieurs étapes, depuis l’éducation des donneurs potentiels jusqu’à l’obtention de données post-don en passant par l’évaluation de chaque donneur (faite, entre autres, grâce à un questionnaire sur les maladies aiguës et les infections chroniques).9 Certaines décisions concernant la sélection des donneurs peuvent avoir une forte incidence sur le recrutement des donneurs. Voir le Chapitre 6 : Sélection des donneurs, dépistage des maladies transmissibles et réduction des agents pathogènes.
Les donneurs jouent un rôle essentiel dans la procédure de sélection. Ils choisissent eux-mêmes de faire une contribution volontaire et acceptent de répondre au questionnaire, de se soumettre à des évaluations et à des analyses, et d’informer le fournisseur de sang de tout changement dans leur santé.
Collecte de sang et analyses
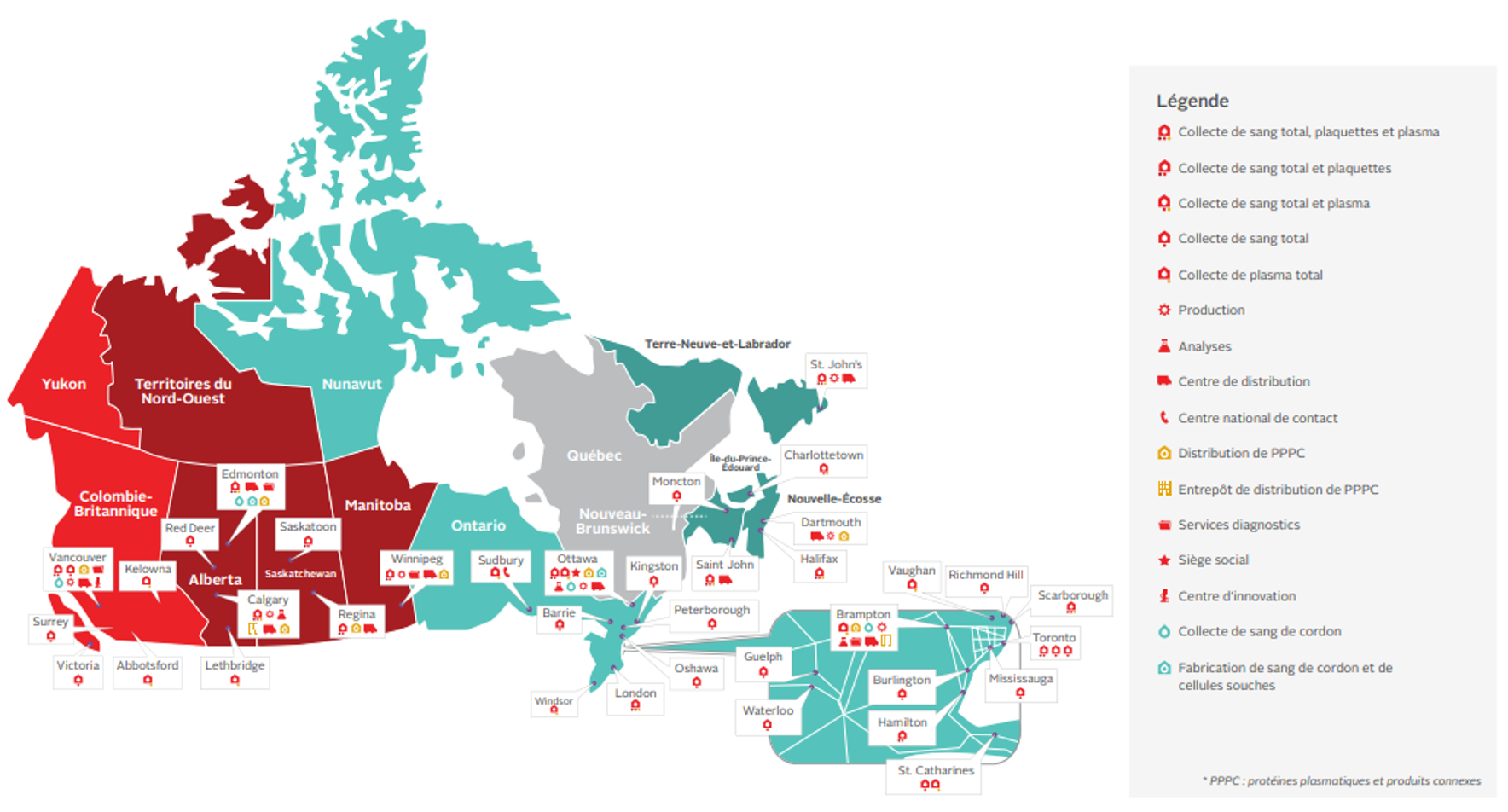
Le prélèvement du sang total et des composants sanguins est la responsabilité des fournisseurs de sang. La Société canadienne du sang prélève chaque année environ un million d’unités de sang et de composants sanguins dans ses centres de donneurs. Durant le processus de prélèvement, le personnel veille au bien-être des donneurs en surveillant la survenue de possibles effets indésirables (voir le Chapitre 6 pour en savoir plus sur la procédure de collecte de sang et le Rapport de surveillance de la Société canadienne du sang au sujet des réactions indésirables liées aux dons). Le personnel doit respecter un ensemble de politiques et de procédures pour assurer l’innocuité et la qualité du sang prélevé.
Les laboratoires de la Société effectuent plusieurs tests de dépistage afin de vérifier si les dons contiennent des agents infectieux pouvant être transmis par transfusion. Pour certains agents (VIH de type 1 et 2, hépatite B, hépatite C), tous les dons sont analysés, tandis que pour d’autres, comme Trypanosoma cruzi, responsable de la maladie de Chagas, on analyse uniquement un sous-groupe, déterminé par le niveau de risque établi en fonction des réponses au questionnaire pré-don.10 Voir le Chapitre 6 : Sélection des donneurs, dépistage des maladies transmissibles et réduction des agents pathogènes pour plus d’informations sur la sélection des donneurs et l’analyse des dons.11
En plus d’analyser les dons de sang, les laboratoires de la Société canadienne du sang appuient la pratique transfusionnelle réalisant des analyses pour les patients des hôpitaux ayant des besoins transfusionnels complexes (voir nos ressources sur le génotypage RHD, l’interprétation des comptes rendus de génotypage RHD et les tests de dépistage des anticorps pouvant affecter la prise en charge de la grossesse).
Avec l’émergence de nouveaux agents pathogènes et le développement des tests (séquençage de prochaine génération) et des technologies de préparation du sang (inactivation des agents pathogènes; voir le Chapitre 19 pour en savoir plus sur le système d’inactivation des agents pathogènes INTERCEPT de Cerus et nos ressources sur le plasma traité au solvant-détergent pour le processus d’inactivation des agents pathogènes utilisé dans le traitement au solvant-détergent), les fournisseurs de sang doivent sans cesse réévaluer leurs procédures de sélection et d’analyse des donneurs afin de garantir l’innocuité de l’approvisionnement en sang tout en veillant à ce que les critères d’admissibilité des donneurs soient aussi inclusifs que possible. Tout changement important aux méthodes de sélection et d’analyse doit être approuvé au préalable par Santé Canada. Au cours des dernières années, sous la direction de la Société canadienne du sang, l’Alliance of Blood Operators (ABO) a conçu un cadre décisionnel fondé sur le risque afin d’aider les fournisseurs de sang à maintenir l’innocuité du sang en prenant des décisions éclairées et en adoptant des mesures proportionnelles aux risques.12La Société canadienne du sang a notamment utilisé ce cadre pour évaluer le risque associé au parasite Babesia microti, au virus Zika et au paludisme, et pour déterminer les mesures à prendre pour la sélection des donneurs et l’analyse des dons.
Préparation des composants sanguins et distribution aux hôpitaux; vente en gros des produits sanguins
Les composants sanguins sont préparés dans les installations des fournisseurs de sang. Pour en savoir plus sur leur préparation, voir le Chapitre 2 sur les composants sanguins.13
Les protéines plasmatiques et produits connexes ainsi que les produits thérapeutiques recombinants (produits sanguins) sont préparés par des sociétés pharmaceutiques et vendus en gros par les fournisseurs de sang aux établissements de santé dont ils ont la charge. La Société canadienne du sang recueille également du plasma qu’elle fournit aux sociétés pharmaceutiques, qui le fractionnent en protéines plasmatiques purifiées. De plus, la Société canadienne du sang négocie avec ces sociétés des contrats pour la fourniture de produits fractionnés et recombinants qui répondent aux besoins de la population canadienne (voir le formulaire de commande des protéines plasmatiques et produits connexes et le Chapitre 5 sur les concentrés pour les troubles de l’hémostase et l’angiœdème héréditaire).14
Les composants sanguins ainsi que les protéines plasmatiques et produits connexes sont conservés dans les établissements de la Société canadienne du sang et expédiés à environ 600 établissements de santé.
Rappel de produits/Retraçage des receveurs et des donneurs
Les fournisseurs de sang doivent être informés de toute information survenant après un don et susceptible d’affecter la qualité et l’innocuité d’un produit. Cette information peut provenir de différentes sources : services du fournisseur de sang (laboratoire, personnel médical, organisme de réglementation), donneurs, hôpitaux et médecins. Ainsi, lorsqu’un patient réagit négativement à un composant sanguin, l’hôpital en informe la Société canadienne du sang (voir le Guide sur la déclaration des réactions transfusionnelles indésirables). Les donneurs qui tombent malades après un don de sang sont également tenus d’en faire rapport à la Société. Tous les rapports sont examinés par la Société canadienne du sang. Diverses démarches sont ensuite entreprises, selon la nature de l’information reçue :
- Retrait du produit : le retrait du produit est soit décidé par le fournisseur de sang sur une base volontaire, soit imposé par Santé Canada, l’organisme de réglementation. La démarche consiste à identifier les composants sanguins posant un risque pour la sécurité du receveur et à les retirer des réserves du fournisseur de sang. Si les composants sanguins identifiés ont déjà été transfusés, une évaluation médicale et les lignes directrices du Comité consultatif national sur le sang et les produits sanguins permettent de déterminer si le receveur doit être avisé.15,16
- Retraçage de donneurs : cette enquête est réalisée lorsqu’il est possible qu’une infection ait été transmise par voie transfusionnelle, comme le virus de l’immunodéficience humaine (VIH), les virus des hépatites B (VHB) et C (VHC), le virus du Nil occidental (VNO) ou encore la maladie de Chagas. La démarche consiste à retracer les donneurs concernés et à obtenir les résultats d’analyse négatifs (d’un don précédent) ou à identifier un donneur dont les résultats ont été positifs pour le marqueur en question. Lorsque la Société canadienne du sang apprend que des analyses ont révélé une infection transmise par voie transfusionnelle et qu’il n’y a aucune autre cause connue, elle identifie le ou les donneurs concernés par les composants sanguins transfusés, les localise et leur fait repasser les tests de dépistage de la maladie en question.
Si les nouveaux tests s’avèrent positifs pour l’agent infectieux et que le donneur a déjà donné du sang, le retraçage du donneur peut mener à un retraçage des receveurs.
- Retraçage de receveurs : le retraçage des receveurs consiste à identifier et à contacter les personnes qui ont reçu des composants sanguins provenant d’un donneur qui, lors d’un don ou d’un test de dépistage subséquent, a obtenu un résultat positif confirmé pour un agent infectieux transmissible comme le VIH, les virus des hépatites B et C, le virus du Nil occidental ou encore la maladie de Chagas. Lorsque la Société canadienne du sang apprend qu’un donneur a obtenu un résultat positif à un test de dépistage d’une maladie transmissible, une étude est menée sur ses dons antérieurs et une procédure de rappel est lancée pour les composants sanguins préparés à partir de ces dons. La Société communique avec les hôpitaux et les fabricants spécialisés dans le processus de fractionnement qui ont reçu des composants et des produits préparés à partir des dons de ce donneur afin d’identifier les receveurs concernés et de les informer de la situation. Les receveurs passent alors un test pour savoir s’ils sont porteurs de l’agent infectieux dépisté chez le donneur. La Société canadienne du sang peut être informée du résultat.
Pour le retraçage des donneurs et des receveurs, il est important d’identifier les individus ayant obtenu des résultats positifs à des infections transmissibles par transfusion pour garantir l’innocuité de l’approvisionnement en sang. Cette démarche est également essentielle pour que les donneurs et les receveurs puissent être tenus informés. Selon l’agent infectieux, les donneurs concernés pourraient être exclus du don de sang indéfiniment. La Société canadienne du sang fait état de toutes ses enquêtes de retraçage dans un rapport qu’elle remet à Santé Canada et dont les résultats sont publiés chaque année dans son Rapport de surveillance.
Hôpitaux
Les hôpitaux jouent un rôle majeur dans l’administration en toute sécurité des composants et produits sanguins selon les meilleures pratiques médicales. Divers cadres de fonctionnement existent, selon la taille de l’établissement, mais trois d’entre eux sont plus courants :
- Le personnel des laboratoires de médecine transfusionnelle (directeurs de laboratoire, spécialistes de la médecine transfusionnelle et agents de sécurité transfusionnelle) et les directeurs médicaux gèrent les stocks de composants et produits sanguins ainsi que leur distribution au personnel clinique. Ils veillent également à ce que les patients reçoivent des composants compatibles. Ils répondent aux enquêtes de retraçage de receveurs, lancent les enquêtes de retraçage de donneurs et signalent toute réaction transfusionnelle indésirable. Ils sont également responsables d’orienter la pratique transfusionnelle ainsi que d’élaborer et de mettre en œuvre des politiques transfusionnelles approuvées par leur établissement ou le comité régional sur la transfusion.
- Les cliniciens prescripteurs (médecins, infirmiers) commandent les composants sanguins et produits sanguins nécessaires aux patients. Ils sont responsables de prescrire les composants et produits sanguins selon les normes et les règlements en place.
Dans la foulée de la commission Krever3, des postes d’agent de sécurité transfusionnelle ont été créés dans la plupart des grands centres hospitaliers du Canada. Ces postes sont occupés par des infirmières autorisées ou des technologues de laboratoires médicaux spécialisés en transfusion. Les titulaires de ces postes sont chargés de veiller à la qualité et à l’innocuité des transfusions effectuées au sein de leur établissement, en particulier dans le service transfusionnel ainsi que dans les unités, les ailes ou les cliniques où se pratiquent des transfusions.
Par ailleurs, des comités de transfusion hospitaliers ou régionaux ont été établis pour superviser les activités transfusionnelles. Ces comités offrent avis et soutien pour favoriser une pratique transfusionnelle sûre. Multidisciplinaires, ils sont formés de médecins, d’infirmiers, de membres du personnel de services transfusionnels et de membres dirigeants.4,17
Autres entités jouant un rôle essentiel : les collèges de médecins et de chirurgiens, et les ministères de la Santé. Ces entités provinciales et territoriales établissent les normes applicables aux laboratoires, dont les laboratoires de médecine transfusionnelle des hôpitaux. Les laboratoires situés dans les provinces et territoires concernés doivent avoir l’agrément et/ou le permis requis et respecter les normes locales applicables.
En vertu du Règlement sur le sang6, Santé Canada exerce une surveillance accrue sur les établissements qui réalisent certaines activités qui pourraient impacter la qualité et l’innocuité des composants sanguins. Les hôpitaux qui transforment les composants sanguins (lavage des globules rouges, irradiation des composants sanguins) doivent être inscrits auprès de Santé Canada et se soumettre régulièrement à des audits gouvernementaux. Les hôpitaux qui entreposent, distribuent et transportent des composants sanguins doivent en outre respecter certaines dispositions du Règlement sur le sang, même si ces activités ne nécessitent aucune inscription particulière.
Autres organisations contribuant au système transfusionnel
D’autres organisations contribuent au système d’approvisionnement en sang du Canada. Ces organisations élaborent des normes et des lignes directrices, et appuient la recherche et l’éducation.
La Société canadienne de médecine transfusionnelle (SCMT) encourage l’excellence dans le domaine de la médecine transfusionnelle au Canada. Cette organisation interprofessionnelle sans but lucratif a été créée en 1979 sous le nom d’Association canadienne des immunohématologistes. La SCMT facilite les activités éducatives relatives à la médecine transfusionnelle, notamment par son activité phare, un congrès annuel organisé par des spécialistes du milieu transfusionnel en partenariat avec la Société canadienne du sang et Héma-Québec. La SCMT joue également un rôle prépondérant dans le développement continu des normes en publiant un ensemble de normes pour services transfusionnels en milieu hospitalier, lesquelles reflètent les meilleures pratiques de médecine factuelle au Canada.17 Conforme à la fois à la norme CSA sur le sang et au Règlement sur le sang de Santé Canada, cette publication favorise une pratique transfusionnelle sûre dans les hôpitaux, en plus de servir d’outil pour l’obtention de l’agrément dans certaines régions.
L’Association for the Advancement of Blood & Biotherapies (AABB) est une association internationale sans but lucratif représentant des individus et des institutions œuvrant dans les domaines de la médecine transfusionnelle et des thérapies cellulaires. Les établissements canadiens appliquent les normes élaborées par cette association dans leurs banques de sang et services transfusionnels. Ses nombreuses ressources éducatives sont également pertinentes pour le système canadien.
Dans son rapport, le commissaire Krever recommandait de faire avancer la recherche, un élément essentiel au maintien d’un système transfusionnel sûr. Au Canada, Santé Canada finance la Société canadienne du sang pour la mise en œuvre d’un programme de recherche-développement.18
L’International Society of Blood Transfusion (ISBT), une organisation scientifique fondée en 1935, favorise la recherche et la mobilisation des connaissances par l’intermédiaire de congrès régionaux et internationaux. L’ISBT prône la normalisation et l’harmonisation de la pratique transfusionnelle. Elle a, par exemple, joué un rôle significatif dans l’élaboration de la norme mondiale sur l’identification, l’étiquetage et le transfert d’information des produits médicaux d’origine humaine (dont les composants sanguins). Cette norme, la norme ISBT 128, a été adoptée au Canada.19 Autre contribution majeure de l’ISBT à la communauté transfusionnelle, la classification des divers groupes sanguins sous une nomenclature commune.
Enfin, l’organisme de recherche international Biomedical Excellence for Safer Transfusion (BEST) collaborative explore des moyens d’améliorer les services associés à la transfusion par la normalisation des méthodes d’analyse, l’élaboration de procédures, l’examen systématique des données et la mise en application d’études cliniques et de laboratoire. À l’heure actuelle, le collectif BEST regroupe des membres provenant de 22 pays, parmi lesquels 42 représentent la communauté scientifique, 8, le secteur de la fabrication et 20, les fournisseurs de sang.
Environnement collaboratif
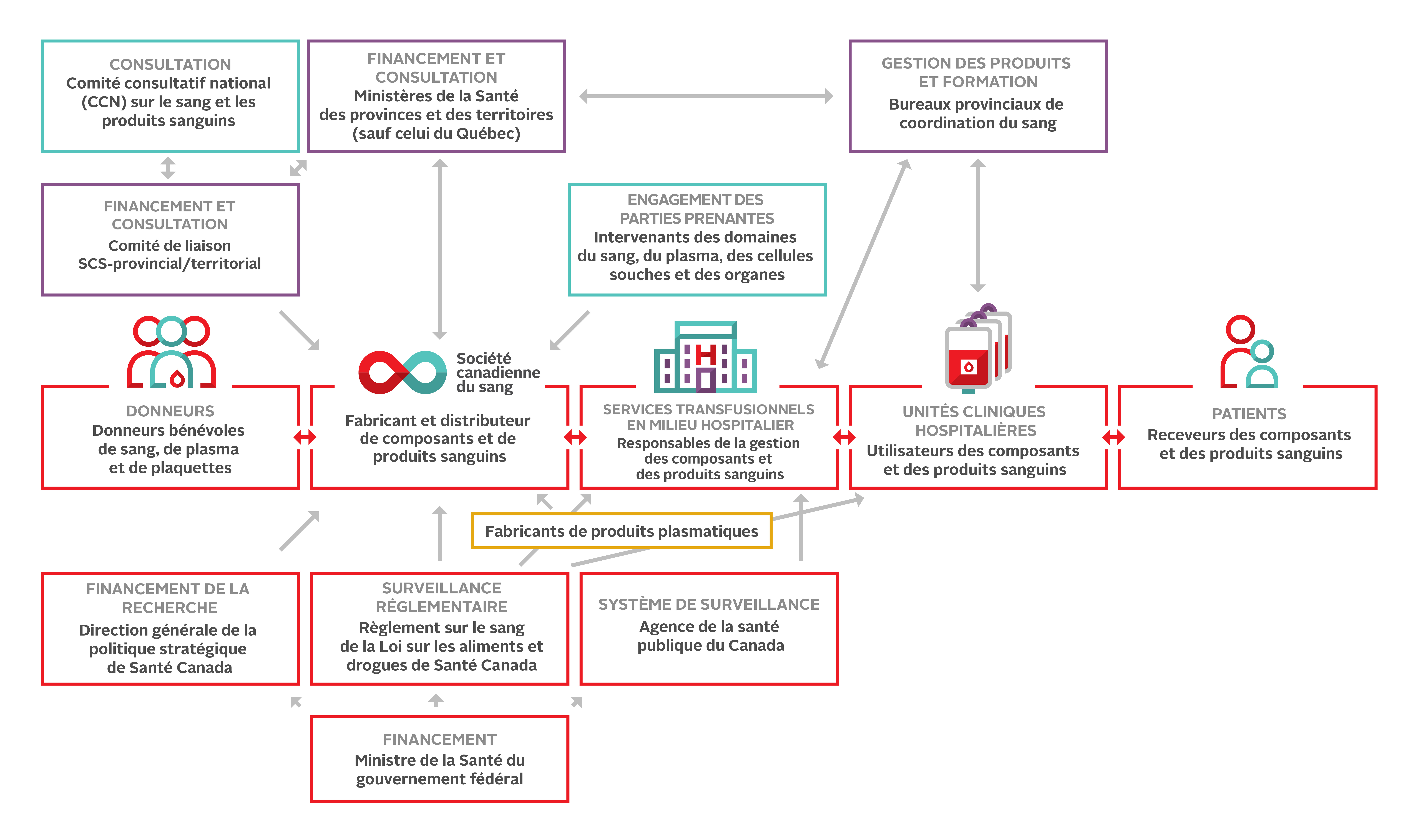
La figure 2 ci-dessous illustre les relations qui encadrent le système canadien d’approvisionnement en sang. Des professionnels engagés, compétents et bienveillants y contribuent à tous les niveaux. Malgré les percées dans le domaine de la science transfusionnelle, le risque demeure; la transfusion ne doit jamais être considérée comme un acte parfaitement sûr.
Au Canada, les décisions sur l’utilisation du sang reviennent principalement au personnel médical des hôpitaux. Les processus de collecte et d’analyse des échantillons sanguins des receveurs, la transfusion des composants et produits sanguins ainsi que la surveillance des receveurs relèvent des professionnels de la santé. La formation continue est cruciale pour toutes les personnes impliquées en médecine transfusionnelle.
Mobilisation des parties prenantes
La Société canadienne du sang bénéficie de la précieuse rétroaction de différents groupes de parties prenantes : consommateurs, donneurs, patients/receveurs, hôpitaux, professionnels de la santé, scientifiques et éthiciens, entre autres.
La Société canadienne du sang se sert de la mobilisation des parties prenantes pour recueillir de la rétroaction sur ses politiques, ses produits et ses activités. Être engagé, c’est écouter, partager de l’information, établir un dialogue et explorer des solutions viables pour les patients, les familles, les soignants, les différentes populations que nous servons et le système de santé dans son ensemble.
Piliers essentiels de l’image de marque de la Société canadienne du sang, l’engagement et la mobilisation permettent à l’organisation de faire participer les parties prenantes à la prise de décisions difficiles et complexes ou encore à la collecte de commentaires pour orienter ces décisions.
Crédits de développement professionnel continu
Les associés et les professionnels de la santé qui participent au Programme de maintien du certificat du Collège royal des médecins et chirurgiens du Canada peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue comme activité de développement professionnel continu au titre de la Section 2 — Apprentissage individuel. Ces personnes peuvent réclamer 0,5 crédit par heure de lecture, jusqu’à hauteur de 30 crédits par année.
Les technologistes médicaux qui participent au Programme d’enrichissement professionnel (PEP) de la Société canadienne de science de laboratoire médical peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue en tant qu’activité non vérifiée.
Citation
Gabarin N, Yan M. Du donneur au receveur : un ouvrage sur l’activité transfusionnelle au Canada. Dans : Khandelwal A, Abe T, éditeurs. Guide de la pratique transfusionnelle [Internet]. Ottawa : Société canadienne du sang, 2024 [cité le JJ MM AAAA]. Chapitre 1. Disponible à : https://professionaleducation.blood.ca/fr
Si vous avez des questions ou des suggestions d’amélioration concernant le Guide de la pratique transfusionnelle, nous vous invitons à utiliser notre formulaire de contact.
Remerciements
Les auteurs remercient Sophie Chargé, qui a rédigé la version précédente de ce chapitre, ainsi que Jennifer Davis, Patrizia Ruoso, Rosanne Dawson, Jon Fawcett, Jennifer Ciavaglia et la Dre Tanya Petraszko pour leur travail de relecture.
Si vous avez des questions ou des suggestions d’amélioration concernant le Guide de la pratique transfusionnelle, nous vous invitons à utiliser notre formulaire de contact.
Références
1. Mulcahy, A.W., Kapinos, A.K., Briscombe, B., et al. Toward a Sustainable Blood Supply in the United States: An Analysis of the Current System and Alternatives for the Future. (ed. RAND Corporation) (Santa Monica, CA, 2016).
2. Picard, A. The gift of death: Confronting Canada’s tainted-blood tragedy, (Harper Collins, Toronto, Canada, 1995).
3. Commission d’enquête sur l’approvisionnement en sang au Canada. Rapport final de L’honorable juge Horace Krever. Annexe H (Ottawa, Ontario, Canada, 1997).
4. Groupe CSA. CAN/CSA-Z902-F15 -- Sang et produits sanguins labiles, (CSA, Canada, 2015).
5. Groupe CSA. CAN/CSA-Z902:F20 -- Sang et produits sanguins labiles, (CSA, Canada, 2020).
6. Santé Canada. Ligne directrice : Règlement sur le sang. (Ottawa, Ontario, Canada, 2014).
7. Centre de la lutte contre les maladies transmissibles et les infections. Système de surveillance des incidents transfusionnels (SSIT) : Résultats sommaires 2009-2013, Vol. 2016 (Agence de la santé publique du Canada, Ottawa, Ontario, Canada, 2016).
8. Organisation mondiale de la Santé. Blood donor selection: Guidelines on assessing donor suitability for blood donation. (Genève, Suisse, 2012).
9. Goldman, M. Donor selection for recipient safety. ISBT Science Series 8, 54-57 (2013).
10. Goldman, M.D., S. J. (ed.) Blood donation testing and the safety of the blood supply, (Wiley Online Library, Hoboken, NJ, 2022).
11. Drews, S., Khandelwal, A., Goldman, M., et coll. Sélection des donneurs, dépistage des maladies transmissibles et réduction des agents pathogènes. Dans : Khandelwal A, Abe T, éditeurs. Guide de la pratique transfusionnelle [Internet]. Ottawa : Société canadienne du sang, 2021. Chapitre 6. Disponible à : https://professionaleducation.blood.ca/fr.
12. Leach Bennett, J., Blajchman, M.A., Delage, G., et al. Proceedings of a consensus conference: Risk-Based Decision Making for Blood Safety. Transfusion medicine reviews 25, 267-292 (2011).
13. Gupta, A. & Bigham, M. Composants sanguins. Dans : Khandelwal A, Abe T, éditeurs. Guide de la pratique transfusionnelle [Internet]. Ottawa : Société canadienne du sang, 2023. Chapitre 2. Disponible à : https://professionaleducation.blood.ca/fr.
14. Poon, M.C., Goodyear, M.D., Rydz, N., et coll. Concentrés pour les troubles de l’hémostase et l’angiœdème héréditaire. Dans : Khandelwal A, Abe T, éditeurs. Guide de la pratique transfusionnelle [Internet]. Ottawa : Société canadienne du sang, 2022. Chapitre 5. Disponible à : https://professionaleducation.blood.ca/fr.
15. Comité consultatif national sur le sang et les produits sanguins et Société canadienne du sang. Recommandations pour prévenir les transfusés de rappel de produits. (Comité consultatif national sur le sang et les produits sanguins, 2015).
16. Petraszko, T., Tinmouth, A., Tran, A., et coll. Recommandations pour prévenir les transfusés en cas de rappel de produits : une initiative conjointe du Comité consultatif national sur le sang et les produits sanguins et de la Société canadienne du sang (Comité consultatif national sur le sang et les produits sanguins, Ottawa, 2023).
17. Comité des normes de la Société canadienne de médecine transfusionnelle. Normes pour services transfusionnels en milieu hospitalier, version 4 (Société canadienne de médecine transfusionnelle, Markham, Canada, 2017).
18. Bureau de l’audit et de l’évaluation, Santé Canada et Agence de la santé publique du Canada. Évaluation des Programmes de la Société canadienne du sang bénéficiaires de contributions de Santé Canada 2013-14 à 2016-2017. (dir. Gouvernement du Canada) (Ottawa, Ontario, Canada, 2018).
19. Armitage, J., Ashford, P., Bolton, W., et al. ISBT 128 Standard -- Technical Specification v5.9.0. (ed. Cabana, E.) (ICCBBA, San Bernardino, CA, USA, 2018).