Chapitre 10
Les réactions transfusionnelles
Résumé
Le présent chapitre porte sur les diverses réactions transfusionnelles qui peuvent survenir en cas de transfusion de composants sanguins (globules rouges, plaquettes et plasma). Pour en savoir plus sur les réactions liées à la transfusion de protéines plasmatiques et produits connexes, il convient de se reporter aux chapitres sur les produits sanguins correspondants : chapitre 3 sur l’albumine, chapitre 4 sur les immunoglobulines et chapitre 5 sur les concentrés pour les troubles de l’hémostase et l’angiœdème héréditaire. Par ailleurs, le consentement éclairé est ici présenté comme une composante essentielle du processus de transfusion; Pour plus d’informations, voir le cours Informed consent for blood transfusion sur notre portail éducationnel. On explore également la prévention des réactions transfusionnelles grâce à l’évaluation du patient, à l’utilisation éventuelle de prémédication, à la prise en charge du donneur, y compris les examens réalisés, ou à la modification des composants. Néanmoins, certaines réactions sont idiosyncratiques et ne peuvent être évitées.
Dans l’ensemble, l’offre de composants sanguins au Canada est sûre et ne présente que de très faibles risques d’infections. Dans le rapport du Système de surveillance des incidents transfusionnels (SSIT) pour 2018-2019, le risque de réactions transfusionnelles était de 1 pour 2 600 unités de composants sanguins transfusés1. Le présent chapitre met l’accent sur les réactions transfusionnelles, et non sur les erreurs ou les accidents. Il y a de nombreuses façons d’appréhender la question des réactions transfusionnelles (p. ex. réaction immédiate ou retardée, infectieuse ou non infectieuse), mais ce chapitre s’appuiera sur une approche systémique.
L’hémovigilance correspond à la surveillance des transfusions sanguines. Il s’agit d’un aspect crucial pour l’amélioration continue de la qualité2. Reconnaître, prendre en charge, prévenir et déclarer des réactions transfusionnelles sont des éléments essentiels pour préserver la sécurité de la fourniture de sang. Les exigences en matière de déclaration au Canada, hors Québec, sont décrites plus en détail dans le guide sur la déclaration des réactions transfusionnelles indésirables.
Consentement éclairé
Le consentement éclairé est une composante nécessaire de la prise en charge médicale : les professionnels de santé fournissent aux patients les renseignements dont ils ont besoin pour prendre des décisions thérapeutiques de leur plein gré, y compris en lien avec la transfusion de sang3. Quel que soit le traitement, le consentement éclairé repose sur les principes suivants : (1) il est volontaire, (2) le patient est apte à prendre des décisions et (3) le patient a été correctement informé4. L’obtention du consentement éclairé implique un entretien sur les bienfaits et les risques du traitement proposé ainsi que sur les autres possibilités de traitement. Les patients ont le droit de poser des questions, d’accepter ou de refuser le traitement et de changer d’avis ultérieurement. Pour solliciter le consentement relatif à une transfusion, les professionnels de santé doivent globalement comprendre les risques en matière de réactions transfusionnelles. Pour en savoir plus sur le consentement éclairé, se reporter au chapitre 9 sur l’administration de produits sanguins.
Dans les situations d’urgence où le patient ou son mandataire ne peuvent pas donner de consentement éclairé, les médecins doivent prodiguer les soins en cas de risque imminent pour la vie ou la santé du patient4. Il est impératif que les médecins honorent toute directive préalable ou tout autre souhait connu du patient.
Les patients peuvent refuser une transfusion sanguine pour tout type de raison, y compris des préoccupations quant aux réactions transfusionnelles, des motifs culturels ou des croyances religieuses. Il est alors tout particulièrement important que les cliniciens maintiennent une relation étroite avec leurs patients, défendent leurs intérêts et documentent leurs souhaits.
Évaluation du risque de réaction transfusionnelle immédiate
Les patients doivent être informés des risques éventuels associés à la transfusion de composants sanguins et faire l’objet d’une évaluation prétransfusionnelle minutieuse. Il est possible de limiter la survenue de certaines réactions telles que la surcharge volémique post-transfusionnelle (TACO) ou la réaction du greffon contre l’hôte post-transfusionnelle (RGCH) (voir le tableau 2). Par ailleurs, il convient d’observer attentivement tout signe ou symptôme de réactions transfusionnelles chez le patient pendant et après la transfusion (figure 1). De plus amples renseignements sur la surveillance des patients figurent dans le chapitre 9 sur l’administration de produits sanguins.
Tableau 1. Sigles utilisés pour les réactions transfusionnelles
| RHI | Réaction transfusionnelle hémolytique immédiate |
| SDRA | Syndrome de détresse respiratoire aiguë |
| RHR | Réaction transfusionnelle hémolytique retardée |
| RFNH | Réaction fébrile non hémolytique |
| TACO | Surcharge circulatoire post-transfusionnelle |
| TAD | Dyspnée associée à la transfusion |
| RGCH | Réaction du greffon contre l’hôte post-transfusionnelle |
| TRALI | Syndrome respiratoire aigu post-transfusionnel |
| PPT | Purpura post-transfusionnel |
Tableau 2. Facteurs à prendre en compte avant la transfusion
| Prémédication |
Il n’y a pas de données probantes solides qui viennent étayer le recours à une prémédication. Il a d’ailleurs été démontré que l’utilisation d’acétaminophène et de diphénhydramine ne permettait pas de prévenir efficacement les réactions fébriles non hémolytiques5 (RFNH) ou les réactions allergiques.6 Il convient d’envisager une prémédication au cas par cas pour les patients qui présentent des antécédents de réactions transfusionnelles. |
| Statut volémique |
Les facteurs de risque pour le TACO incluent les antécédents d’insuffisance cardiaque congestive, de coronaropathie et d’insuffisance rénale ainsi que les deux extrêmes d’âge.7, 8 Afin d’atténuer le risque de surcharge volémique, on peut envisager de ralentir le débit de la transfusion et d’administrer des diurétiques avant la transfusion. Chez des patients stables sans saignement, il est prudent de transfuser une unité à la fois et d’évaluer ensuite à nouveau la situation.9 |
| Composants sanguins modifiés ou de phénotypes particuliers |
Sang irradié Les recommandations 2018 du Comité consultatif national (CCN) sur le sang et les produits sanguins précisent quelles populations de patients doivent recevoir du sang irradié.10 De plus amples détails à ce sujet figurent dans la section ci-dessous sur la réaction du greffon contre l’hôte post-transfusionnelle. Le chapitre 15 offre des renseignements complémentaires sur les composants sanguins irradiés. Sang dépourvu d’antigènes Les patients qui présentent des phénotypes sanguins rares ou des allo-anticorps peuvent nécessiter du sang dépourvu de certains antigènes. Composants sanguins lavés Laver un composant sanguin a pour but d’en retirer le plasma. C’est un processus qui représente une large charge de travail et qui peut réduire la durée de conservation d’un composant. Par conséquent, il doit être utilisé avec discernement. On peut par exemple l’envisager pour les patients qui ont fait de graves réactions à des transfusions antérieures. Une information détaillée sur les composants sanguins lavés est disponible au chapitre 15. |
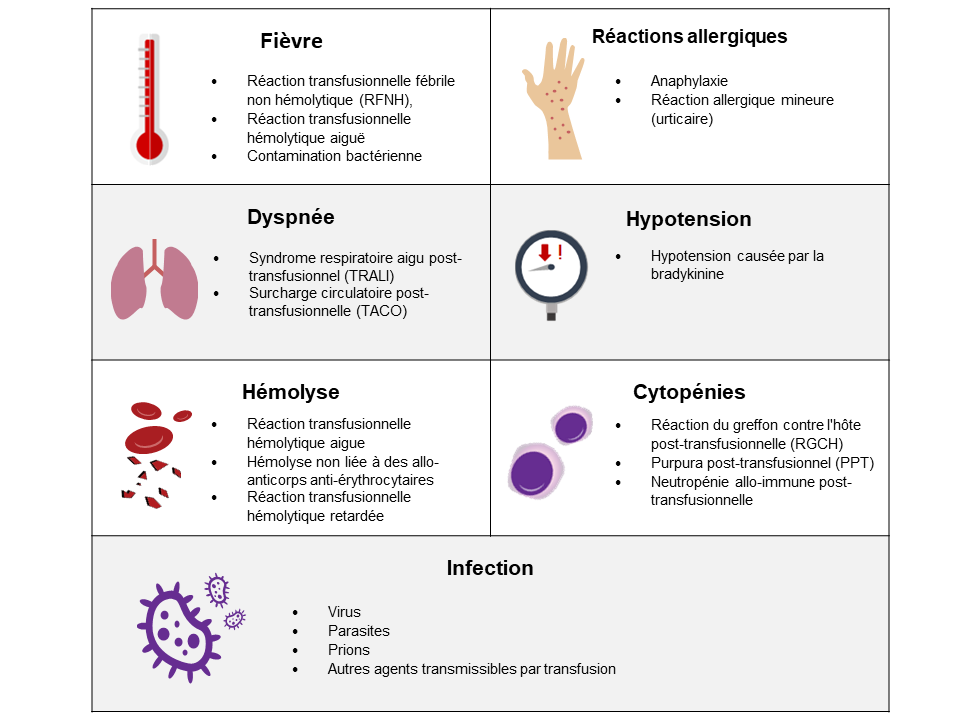
Figure 1. Signes, symptômes et étiologies potentielles d’une réaction transfusionnelle
Fièvre
Après une transfusion, une fièvre est diagnostiquée si le patient présente une augmentation de température supérieure à 1 °C et/ou il a plus de 38 °C pendant la transfusion ou jusqu’à quatre heures après.
Le diagnostic différentiel de fièvre pendant une transfusion inclut une réaction fébrile non hémolytique (RFNH), une réaction hémolytique immédiate (RHI), un syndrome respiratoire aigu post-transfusionnel (TRALI), une contamination bactérienne (voir FAQ : Le dépistage bactériologique des plaquettes à la Société canadienne du sang) et des étiologies non liées à la transfusion elle-même (p. ex. septicémie sous-jacente).
Réaction transfusionnelle fébrile non hémolytique
La RFNH est l’une des réactions transfusionnelles les plus fréquentes, son incidence étant estimée à 4,6 % pour les transfusions de plaquettes et à 0,33 % pour les transfusions de globules rouges6. Au Canada, on estime qu’une RFNH survient selon un rapport de 2,4 pour 1 000 transfusions11. Les frissons, crises de frisson solennel ou douleurs sont autant de manifestations cliniques de la RFNH11. Il semblerait que cette réaction soit le résultat de cytokines inflammatoires ou d’anticorps du receveur dirigés contre les leucocytes du donneur11. Un traitement de soutien, pouvant inclure de l’acétaminophène, est alors principalement administré. Dans de rares cas de crises sévères de frisson solennel, l’administration de péthidine peut être envisagée afin de soulager les symptômes. L’utilisation prophylactique d’acétaminophène et de diphénhydramine est inefficace pour réduire la survenue de RFNH12.
Réaction transfusionnelle hémolytique immédiate
La RHI est une réaction transfusionnelle rare mais potentiellement dévastatrice. Les symptômes peuvent inclure fièvre, frissons, hémoglobinurie, douleurs, dyspnée, hypotension et oligurie13. Les réactions hémolytiques immédiates peuvent être dues à des causes immunitaires, y compris l’incompatibilité ABO, la transfusion d’anti-A et/ou d’anti-B à un patient qui n’est pas du groupe O ou encore l’incompatibilité avec d’autres groupes sanguins. La gravité de ces réactions dépend de divers facteurs, p. ex. le volume de composant transfusé, les caractéristiques des allo-anticorps ou d’autres problèmes sous-jacents du patient. Si l’on suspecte une RHI, la transfusion doit être arrêtée immédiatement et la banque de sang doit être avisée.
Des analyses de laboratoire peuvent mettre en évidence une incompatibilité sérologique (test direct à l’antiglobuline positif, incompatibilité après épreuves répétées de compatibilité croisée), des signes d’hémolyse (élévation du taux de lactate-déshydrogénase [LDH], hausse de la bilirubine, faible taux d’haptoglobine, hémoglobinémie), une insuffisance rénale aiguë ou une coagulation intravasculaire disséminée (CIVD). Le traitement de soutien comprend une surveillance étroite et une hydratation13. Les erreurs matérielles sont un facteur important contribuant à une transfusion ABO incompatible. Il est donc essentiel de disposer de stratégies de prévention des erreurs de transfusion. Cela peut inclure l’identification électronique du patient14, l’utilisation appropriée des composants sanguins, une politique stricte d’étiquetage des échantillons et un examen approfondi des erreurs transfusionnelles, le cas échéant.
Contamination bactérienne
La contamination bactérienne est un risque transfusionnel peu courant. À la Société canadienne du sang, environ 0,09 % des mélanges plaquettaires et 0,04 % des unités de plaquettes d’aphérèse présentent des résultats positifs confirmés de contamination bactérienne15. Le taux de réactions septiques liées à des transfusions de plaquettes est estimé à 1 pour 100 00016. Les composants sanguins peuvent être contaminés par des bactéries Gram positives (p. ex. Staphylococcus aureus, Staphylococcus epidermidis, Bacillus cereus) ou Gram négatives (p. ex. Escherichia coli, Serratia, Klebsiella pneumonia, Pseudomonas). La contamination peut entraîner une fièvre, une tachycardie et une hypotension. Si l’on suspecte une contamination bactérienne, la transfusion doit être arrêtée immédiatement, des cultures de l’unité transfusée et du receveur doivent être demandées et une antibiothérapie empirique peut être administrée. Il est important d’avertir la banque de sang qui avisera alors la Société canadienne du sang si des composants sanguins du même donneur doivent être retirés des stocks.
La Société canadienne du sang a recours à de multiples stratégies pour atténuer le risque de contamination bactérienne, y compris la désinfection des sites de ponction veineuse du donneur, l’élimination du premier aliquote du sang prélevé et des systèmes de détection par mise en culture17. De plus amples renseignements sur les analyses bactériologiques des plaquettes sont disponibles dans notre FAQ sur le dépistage bactériologique des plaquettes à la Société canadienne du sang. L’inactivation des pathogènes est une mesure de sécurité supplémentaire contre un certain nombre d’agents pathogènes, bactéries et virus inclus. En endommageant efficacement les acides nucléiques des agents pathogènes, le processus d’inactivation réduit encore davantage leur risque de transmission. Vous pouvez consulter le chapitre 19 pour en savoir plus sur les plaquettes à teneur réduite en agents pathogènes.
Dyspnée
Une dyspnée ou hypoxémie peut survenir au cours d’une transfusion. Ce symptôme peut être dû à deux causes importantes liées à une transfusion : la surcharge circulatoire post-transfusionnelle (TACO) ou le syndrome respiratoire aigu post-transfusionnel (TRALI).
Surcharge circulatoire post-transfusionnelle
Les TACO sont une cause importante de morbidité et de mortalité associées à une transfusion5. Cette réaction se caractérise par un essoufflement et des signes de surcharge volémique. Les critères relatifs à la déclaration de TACO ont été mis à jour en 2018 par le groupe de travail sur l’hémovigilance de l’International Society of Blood Transfusion (ISBT), en collaboration avec l’International Haemovigilance Network (IHN) et l’Association for the Advancement of Blood & Biotherapies (AABB) (voir le tableau 3). De nombreux facteurs sont suspectés pour la physiopathologie des TACO, notamment une augmentation de la pression hydrostatique due à la surcharge volémique et une augmentation de la filtration liquidienne du fait de l’inflammation18. Il est important d’identifier les patients à risque de TACO et d’envisager des mesures prophylactiques telles que limiter les transfusions, réduire le débit ou administrer des diurétiques avant une transfusion. Si l’on suspecte un TACO, la transfusion doit être arrêtée et des diurétiques doivent être administrés pour traiter l’œdème pulmonaire. Un traitement de soutien, comme l’administration supplémentaire d’oxygène, doit également être prodigué.
Tableau 3 : Définition révisée pour la surveillance des cas de TACO, proposée par le groupe de travail sur l’hémovigilance de l’ISBT en collaboration avec l’IHN et l’AABB19
| Définition révisée de l’ISBT-IHN-AABB relative à la surveillance des cas de TACO (2018) | |
|---|---|
|
Pour être catégorisés comme souffrant d’un TACO (diagnostic de surveillance), les patients doivent satisfaire à au moins un critère obligatoire* survenant pendant la transfusion ou jusqu’à 12 heures après et à au moins trois critères au total : * Critères obligatoires |
|
| A | Atteinte respiratoire aiguë ou qui s’aggrave et/ou |
| B |
Signes probants d’œdème pulmonaire aigu ou s’aggravant basés sur :
|
| C | Instauration de changements au niveau du système cardiovasculaire qui ne sont pas expliqués par l’état médical sous-jacent du patient, y compris survenue d’une tachycardie, d’une hypertension, d’une distension de la veine jugulaire, d’une hypertrophie cardiaque et/ou d’un œdème périphérique |
| D | Signes probants de surcharge volémique, y compris bilan liquidien positif, amélioration clinique après diurèse |
| E | Résultat corroborant d’un biomarqueur pertinent, p. ex. hausse des taux de peptide natriurétique de type B (BNP ou NT-pro BNP) au-dessus de la fourchette de référence pour chaque groupe d’âge et supérieure à 1,5 fois la valeur prétransfusionnelle |
| * A et/ou B, et au moins trois au total (A à E) | |
Syndrome respiratoire aigu post-transfusionnel
Le TRALI est un état qui se caractérise par un œdème pulmonaire non cardiogénique et une insuffisance respiratoire. Il s’agit de la principale cause de morbidité et de mortalité associées à une transfusion18. Les mécanismes physiopathologiques proposés ne sont pas totalement clairs, mais l’on suppose un mécanisme à double médiation. Un problème clinique sous-jacent prédispose le patient au TRALI et constitue le premier facteur. Le deuxième facteur est lié au composant sanguin transfusé (p. ex. anticorps leucocytaires du donneur dirigés contre les antigènes correspondants du receveur ou modificateurs de la réponse biologique présents dans l’unité transfusée)18. Pour de plus amples renseignements concernant les TRALI, y compris le diagnostic et la prise en charge, il convient de se reporter à la publication de la Société canadienne du sang intitulée « Syndrome respiratoire aigu post-transfusionnel (TRALI) ».
La définition du TRALI établie lors de la conférence canadienne de consensus sur le TRALI qui a eu lieu en 2004 a fait l’objet d’un projet de révision et est présentée dans le tableau 4.
Tableau 4. Nouvelle proposition de consensus pour la définition du TRALI20
|
TRALI de type I |
Les patients n’ont pas de facteur de risque d’un syndrome de détresse respiratoire aiguë (SDRA) et répondent aux critères suivants : a) i. Apparition immédiate ii. Hypoxémie (Pa02/FiO2 < 300 mmHg ou SpO2 < 90 % à l’air ambiant) iii. Œdème pulmonaire bilatéral clairement visible à l’imagerie iv. Aucun signe d’hypertension auriculaire gauche ou, si c’est le cas, ne constitue pas le facteur principal de l’hypoxémie. b) Pendant la transfusion ou dans les six heures suivantes c) Aucun lien temporel avec un autre facteur de risque de syndrome respiratoire aigu |
| TRALI de type II |
Les patients ont des facteurs de risque de SDRA (mais n’ont pas reçu un diagnostic correspondant) ou souffrent d’un SDRA léger (rapport PaO2/FiO2* de 200-300) et voient leur statut respiratoire se détériorer et nécessiter une transfusion sur la base des éléments suivants : a) Mêmes critères définis dans les catégories a et b du TRALI de type 1, et b) Fonction pulmonaire stable dans les 12 heures précédant la transfusion |
| *PaO2 : pression partielle de l’oxygène; FiO2 : fraction inspirée en oxygène | |
Bien que le tableau initial du TACO et du TRALI puisse être similaire, il est important de bien différencier ces deux réactions, car leur prise en charge est différente (voir le tableau 5).
Tableau 5. Caractéristiques du TACO et du TRALI : comparaison et différenciation
| TACO | TRALI | |
|---|---|---|
| Apparition | Survient pendant la transfusion ou jusqu’à 12 heures après | Survient pendant la transfusion ou dans les six heures suivantes |
| Fièvre | Généralement absente, mais peut être présente6 | Peut être présente |
| Œdème pulmonaire | Oui | Oui |
| Pression artérielle | Potentiellement accrue | Potentiellement diminuée |
| Signes de surcharge volémique | Oui | Hétérogène |
| Réponse aux diurétiques | Oui | Hétérogène |
| Élévation du taux de BNP (peptide natriurétique cérébral) | Oui | Hétérogène |
Dyspnée associée à la transfusion (TAD)
À l’heure actuelle, la définition de la dyspnée associée à la transfusion (TAD) n’est pas clairement établie21. Selon le National Healthcare Safety Network (NHSN), la dyspnée associée à la transfusion se définit comme une détresse respiratoire aiguë survenant dans les 24 heures suivant une transfusion et ne correspondant ni à un TACO, ni à un TRALI, ni à une réaction allergique22.
Réactions allergiques
La physiopathologie exacte des réactions allergiques n’est pas clairement déterminée, mais ces réactions pourraient être liées à l’exposition à certaines protéines plasmatiques23, 24. Par ailleurs, des allergènes alimentaires et chimiques ont également été documentés comme étant à l’origine de réactions allergiques25. Enfin, d’aucuns supposent que des voies indépendantes des allergènes ainsi que des médiateurs inflammatoires dans les composants sanguins pourraient déclencher une réaction allergique23.
Réaction allergique mineure
Les réactions allergiques mineures se manifestent par de l’urticaire, un prurit, des rougeurs, des symptômes respiratoires mineurs des voies aériennes supérieures ou des symptômes gastro-intestinaux26. Elles sont plus fréquentes après des transfusions de plaquettes et de plasma. En règle générale, ces réactions se résorbent d’elles-mêmes et l’on peut souvent reprendre la transfusion à un débit inférieur en l’absence de signes d’une réaction allergique sévère. L’acétaminophène et la diphénhydramine en prémédication n’ont pas permis de démontrer une réduction nette des réactions transfusionnelles allergiques27. À titre de mesures de prévention, il est également possible de modifier les composants sanguins (p. ex. déplétion du plasma, lavage) pour les patients présentant des réactions allergiques répétées. En cas de réaction allergique mineure, un traitement à base d’antihistaminiques peut être administré.
Anaphylaxie
L’anaphylaxie est une grave complication systémique qui peut survenir dans de rares cas lors d’une transfusion de composants sanguins. Son incidence est estimée à 1 cas sur 50 000 transfusions de globules rouges28. Les exemples de critères diagnostiques de l’anaphylaxie sont énumérés ci-dessous (figure 2)29.

Figure 2 : Critères diagnostiques de l’anaphylaxie
Le traitement immédiat doit mettre la priorité sur la préservation des voies aériennes, de la respiration et de la circulation du patient. L’administration d’épinéphrine, d’antihistaminiques, de stéroïdes et d’agonistes bêta-2 inhalés peut être envisagée.
Il est important de garder à l’esprit un large diagnostic différentiel sur la base des symptômes du patient et d’en tenir compte au moment de déterminer les examens à mener. Par exemple, dans le contexte d’une hypotension, il convient également d’envisager une septicémie, une réaction causée par la bradykinine ou une réaction hémolytique immédiate. De même, en cas de détresse respiratoire, d’autres causes de dyspnée, à l’instar du TACO et du TRALI, doivent être prises en compte.
Auparavant, il avait été envisagé que la présence d’anti-IgA dans le cadre d’une déficience en IgA puisse être à l’origine de réactions allergiques30. Cependant, des données récentes montrent l’absence de lien solide entre déficience en IgA avec anti-IgA et réactions transfusionnelles anaphylactiques28 (voir la publication de la Société canadienne du sang intitulée « Réactions transfusionnelles anaphylactiques et déficit en IgA » pour des renseignements détaillés). En revanche, des réactions anaphylactiques ont été associées à une déficience en haptoglobine et à la présence d’anticorps anti-haptoglobine31. Enfin, des cas de réactions anaphylactiques dans le cadre d’un transfert passif d’IgE32 par transfusion et d’un transfert d’allergènes alimentaires dans les produits sanguins ont été signalés33.
Hypotension
Il existe de nombreuses causes possibles d’hypotension dans le cadre d’une transfusion de composants sanguins. Contamination bactérienne, TRALI, anaphylaxie et réactions hémolytiques immédiates sont autant de situations pouvant se manifester par une hypotension. Celle-ci peut également être due à des facteurs non liés à la transfusion, comme un saignement sous-jacent ou une exsanguination. De ce fait, il est essentiel de procéder à une évaluation approfondie du patient et des symptômes concomitants afin d’affiner le diagnostic différentiel.
Hypotension causée par la bradykinine
Une hypotension a également été associée à la bradykinine, une molécule inflammatoire responsable de la contraction des muscles lisses et de la vasodilatation34. Selon le Système de surveillance des incidents transfusionnels (SSIT), une chute de la pression artérielle systolique d’au moins 30 mmHg et une pression artérielle systolique inférieure à 80 mmHg constitue une réaction hypotensive35. L’interaction entre le facteur XII dans le plasma et les surfaces chargées négativement (filtres sanguins, membranes de dialyse, systèmes de tubulure) peut entraîner la production de bradykinine9. L’enzyme de conversion de l’angiotensine (ECA) peut inactiver les bradykinines; ainsi, des inhibiteurs de l’ECA peuvent être à l’origine de concentrations accrues de bradykinine et augmenter le risque d’hypotension34. La survenue d’hypotension pendant l’aphérèse chez des patients qui reçoivent un traitement par inhibiteurs de l’ECA est bien documentée36, 37 et il faut donc arrêter le traitement avant la procédure. Si l’on suspecte une hypotension causée par la bradykinine, la transfusion doit être interrompue et des liquides doivent être administrés en IV s’il y a lieu.
Cytopénies retardées
Après la transfusion d’une dose adulte de plaquettes, on peut s’attendre à une augmentation de la numération plaquettaire d’environ 15-25 x 109/l (en l’absence de consommation/séquestration)38. Après la transfusion d’une unité de globules rouges, on observe généralement une hausse de la concentration d’hémoglobine de 10 g/l (en l’absence de perte de sang/hémolyse en cours). Bien que cela soit rare, il arrive que les receveurs de composants sanguins présentent une baisse paradoxale de leur formule sanguine. Une réaction transfusionnelle hémolytique retardée, une réaction du greffon contre l’hôte post-transfusionnelle, un purpura post-transfusionnel et une neutropénie allo-immune post-transfusionnelle peuvent engendrer des cytopénies.
Réaction transfusionnelle hémolytique retardée
Les réactions transfusionnelles hémolytiques retardées (RHR) ont tendance à survenir plus de 24 heures après la transfusion. Elles peuvent s’accompagner de jaunisse, d’une faible fièvre et de signes biologiques d’hémolyse (taux de LDH élevé, baisse du taux d’haptoglobine et test direct à l’antiglobuline positif). Le délai médian avant la survenue est de 1 à 2 semaines après la transfusion. Ce type de réactions peut être lié à des allo-anticorps anti-érythrocytaires, Ie plus souvent dirigés contre E, JKa, c, Fya et K, même si beaucoup d’autres allo-anticorps peuvent causer une hémolyse39. En cas de RHR, les examens réalisés peuvent inclure le phénotypage d’un échantillon prétransfusionnel, le phénotypage des globules rouges transfusés pour l’antigène suspecté et le recueil d’un éluat à partir d’un échantillon de globules rouges post-transfusionnel. De nombreuses stratégies permettent d’éviter une RHR : transfuser uniquement en cas d’absolue nécessité, renouveler les dépistages d’anticorps, consigner les antécédents relatifs aux anticorps dans le dossier du patient, échanger les renseignements entre les banques de sang et établir la compatibilité antigénique prophylactique pour certaines populations. Ainsi, le collectif International Collaboration for Transfusion Medicine Guidelines (ICTMG) recommande que les patients atteints de drépanocytose reçoivent du sang avec compatibilité Rh et K (C, E, c, e, K) et préconise d’envisager également une compatibilité élargie pour les antigènes Kidd, Duffy et S/s chez les patients présentant des allo-anticorps40.
D’autre part, une hémolyse peut être causée par des facteurs non immunitaires. Un lien a par exemple été établi avec le fait de chauffer les globules rouges à une température supérieure à 45 °C41. Une transfusion réalisée à l’aide d’aiguilles de petit calibre42 ou via des filtres obstrués peut également entraîner une hémolyse mécanique. Enfin, une telle réaction peut survenir lorsque les composants sanguins sont périmés ou mal entreposés.
Purpura post-transfusionnel
Le purpura post-transfusionnel (PPT) se manifeste par une thrombocytopénie sévère survenant dans les deux semaines suivant une transfusion43. Du fait des complications hémorragiques, le PPT est associé à un taux de mortalité de 10 à 20 %44. On pense que les mécanismes sous-jacents du PPT sont liés à des allo-anticorps anti-HPA (antigènes plaquettaires humains) qui entraînent la destruction des plaquettes transfusées et des propres plaquettes du patient11. Le mécanisme exact à l’origine de la clairance plaquettaire autologue n’est pas clairement établi, mais l’on suppose les processus suivants43 :
- destruction due à une adhérence spécifique et non spécifique des complexes immunitaires (c.-à-d. anti-HPA-1a et HPA-1a transfusés) qui se lient aux plaquettes autologues;
- production concomitante d’auto-anticorps plaquettaires avec les allo-anticorps.
Le risque de PPT peut être abaissé par une utilisation judicieuse des composants sanguins et par leur déleucocytation. La déleucocytation peut prévenir la contamination plaquettaire des unités de globules rouges et réduire la probabilité de formation d’anticorps43. Pour les patients qui présentent des anticorps anti-HPA connus, on peut envisager le lavage des globules rouges ou la transfusion de plaquettes HPA spécifiques. Le traitement de première intention du PPT consiste à administrer des immunoglobulines intraveineuses (IgIV)43. D’autres traitements possibles incluent l’administration de stéroïdes ou la plasmaphérèse. Avant le premier traitement par IgIV, il convient de recueillir des échantillons destinés aux tests de détection des anticorps anti-HPA. La transfusion de plaquettes peut ne pas entraîner d’augmentation significative de la numération plaquettaire, même si le composant est négatif pour l’antigène plaquettaire concerné43.
Réaction du greffon contre l’hôte post-transfusionnelle
La RGCH est une réaction transfusionnelle très rare : les lymphocytes viables du donneur qui sont transfusés se greffent au niveau des tissus du receveur et les attaquent. Le taux de mortalité estimé est supérieur à 90 %45. Le tableau clinique d’une RGCH est variable et peut comprendre des éruptions cutanées, une élévation des transaminases, de la fièvre, des symptômes gastro-intestinaux et/ou une pancytopénie. Afin de diagnostiquer la réaction, une biopsie (p. ex. cutanée) peut être utile. On peut également évaluer le chimérisme.
Parmi les facteurs de risque, il faut tenir compte de l’immunodéficience potentiellement due à des malignités sous-jacentes, à des traitements ou à une greffe de cellules hématopoïétiques. Les produits HLA spécifiques et la transfusion dans des populations où il existe un degré élevé de similarité HLA entre les individus (ex., au Japon) peuvent aussi être un facteur contributif46. Le système immunitaire du receveur peut alors être incapable d’éliminer correctement les lymphocytes T du donneur du fait de la compatibilité HLA partielle. On peut conceptualiser les facteurs de risque en deux catégories : ceux liés au patient et ceux liés au composant (voir le tableau 6). Il convient de noter qu’un examen systématique réalisé en 2015 a révélé qu’environ la moitié des cas de RGCH était survenue chez des patients dont le risque n’aurait pas été suspecté47.
Tableau 6. Facteurs de risque de la RGCH
| Facteurs de risque liés au patient | Facteurs de risque liés au composant |
|---|---|
|
|
Afin de réduire le risque de RGCH, il est possible d’irradier les composants sanguins avant la transfusion. L’irradiation empêche la réplication des lymphocytes T. Le chapitre 15 sur les composants sanguins négatifs pour les anti-CMV, irradiés et lavés fournit de l’information détaillée à ce sujet. Les recommandations du Comité consultatif national sur le sang et les produits sanguins (CCN) constituent un guide pour les cas de figure où des composants sanguins irradiés doivent être utilisés10. Dans la mesure où l’irradiation a des répercussions majeures sur la qualité des composants érythrocytaires conservés, ce procédé doit avoir lieu dans la mesure du possible juste avant la transfusion. Lorsque des globules rouges irradiés ne sont pas disponibles, la conservation hypothermique des composants pendant au moins 21 jours s’est révélée suffisante dans une étude de 2021 pour inactiver les lymphocytes T, ce qui pourrait contribuer à prévenir une RGCH48. En cas d’occurrence d’une RGCH, le traitement peut inclure une immunosuppression et éventuellement, une greffe de moelle osseuse.
Neutropénie allo-immune post-transfusionnelle
Une neutropénie allo-immune post-transfusionnelle est un effet secondaire très rare, souvent associé au TRALI49. On suppose que des anticorps du donneur ciblant les neutrophiles peuvent contribuer au mécanisme sous-jacent de cette réaction transfusionnelle50. Son incidence est estimée à moins de 1 cas sur 10 000 transfusions50.
Infection
Le risque d’infection transmise par des composants sanguins est rare. Afin de limiter le risque d’agents transmissibles par transfusion, on procède à une sélection des donneurs et à des tests sur tous les dons de sang (pour en savoir plus, voir le chapitre 6 sur le dépistage des maladies transmissibles à la Société canadienne du sang). Les dons font l’objet de tests de dépistage pour divers virus, tels que le VIH, les virus des hépatites B et C, le HTLV et le virus du Nil occidental (de manière saisonnière ou en cas de risque lié à un déplacement). Des analyses sérologiques de détection du cytomégalovirus sont également effectuées pour les composants utilisés pour la transfusion intra-utérine. La maladie de Chagas causée par le parasite Trypanosoma cruzi est également dépistée si le donneur est considéré à risque à partir du questionnaire pré-don. La présence de la bactérie Treponema pallidum responsable de la syphilis est également recherchée dans tous les dons. Par ailleurs, les plaquettes qui ne sont pas à teneur réduite en agents pathogènes sont également soumises à un dépistage bactériologique (voir la FAQ : Le dépistage bactériologique des plaquettes à la Société canadienne du sang). Pour en savoir plus sur la surveillance du risque infectieux à la Société canadienne du sang, vous pouvez consulter le rapport de surveillance annuel.
La fenêtre sérologique correspond à l’intervalle entre la période d’infectiosité et l’apparition de marqueurs détectables de la maladie, p. ex. des anticorps spécifiques ou des séquences d’acides nucléiques viraux. Pendant cette période, il existe un risque qu’une maladie soit présente sans être détectée. Actuellement, on estime les durées de fenêtre sérologique suivantes :
- 10 jours pour le VIH
- 8 jours pour le VHC
- 38 jours pour le VHB
En janvier 2022, la Société canadienne du sang a introduit les plaquettes à teneur réduite en agents pathogènes (plaquettes mélangées traitées au psoralène ou PMTP), un composant fabriqué à l’aide d’une technologie d’inactivation des agents pathogènes, sur son site de production d’Ottawa. Pour de plus amples renseignements à ce sujet, y compris sur le mécanisme d’action de la technologie d’inactivation des pathogènes INTERCEPT de Cerus, veuillez consulter le chapitre 19. Pour une vue d’ensemble des systèmes d’inactivation des agents pathogènes utilisés pour les composants sanguins, veuillez vous reporter au chapitre 6 : Sélection des donneurs, dépistage des maladies transmissibles et réduction des agents pathogènes.
Autres
Surcharge en fer
Des transfusions chroniques peuvent être nécessaires dans différents contextes pathologiques, p. ex. en cas de tumeurs malignes hématologiques, d’anémie hémolytique congénitale, d’anémie aplasique ou d’autres problèmes médicaux entraînant une érythropoïèse inefficace51. On estime qu’une unité de globules rouges contient entre 200 et 250 mg de fer51 et le risque de dépôt dans les tissus augmente après la transfusion d’environ 10 à 20 unités de globules rouges51. L’accumulation de fer dans le cœur, le foie et les organes endocrines peut entraîner un dysfonctionnement significatif des organes. Par exemple, des anomalies endocriniennes possibles sont notamment l’hypogonadisme hypogonadotrophique, le diabète sucré et l’ostéoporose52.
Un diagnostic de surcharge en fer peut être réalisé en évaluant la concentration de fer hépatique grâce à des examens par IRM53. D’autres tests, comme le taux de ferritine ou le coefficient de saturation de la transferrine, ne sont pas aussi précis que l’IRM, mais peuvent être utiles pour surveiller la réponse au traitement. La prise en charge d’une surcharge en fer dépend de la cause sous-jacente. Lorsqu’il est nécessaire de procéder à des transfusions chroniques, la chélation permet de réduire la charge en fer. Des chélateurs peuvent être administrés sous forme de comprimés oraux ou par voie parentérale.
Crédits de développement professionnel continu
Les associés et les professionnels de la santé qui participent au Programme de maintien du certificat du Collège royal des médecins et chirurgiens du Canada peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue comme activité de développement professionnel continu au titre de la Section 2 — Apprentissage individuel. Ces personnes peuvent réclamer 0,5 crédit par heure de lecture, jusqu’à hauteur de 30 crédits par année.
Les technologistes médicaux qui participent au Programme d’enrichissement professionnel (PEP) de la Société canadienne de science de laboratoire médical peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue en tant qu’activité non vérifiée.
Remerciements
Les auteurs remercient Michelle Zeller, M.D., FRCPC, MHPE, DRCPSC, pour la révision du présent chapitre.
N’hésitez pas à nous faire part de vos suggestions et de vos questions concernant le Guide de la pratique transfusionnelle par le biais de notre formulaire.
Suggestion de citation
Laureano M, Khandelwal A, Yan M. Les réactions indésirables. Dans Khandelwal A, Abe T (dir.), Guide de la pratique transfusionnelle [Internet]. Ottawa, Société canadienne du sang. 2022 [cité le AAAA MM JJ]. Chapitre 10. Disponible sur le site Web : https://developpementprofessionnel.sang.ca
Bibliographie
- Public Health Agency of Canada. Transfusion Transmitted Injuries Surveillance System (TTISS), 2018-2019. Vol. 2022 (Government of Canada, 2018).
- World Health Organization. A guide to establishing a national haemovigilance system. Vol. 2022 (World Health Organization, 2018).
- Appelbaum, P.S. Assessment of Patients' Competence to Consent to Treatment. New England Journal of Medicine 357, 1834-1840 (2007).
- Canadian Medical Protective Association. Consent: A guide for Canadian physicians. (CMPA, 2021).
- Public Health Agency of Canada. Transfusion Transmitted Injuries Surveillance System 2011 - 2015 Summary Report (2015).
- Geiger, T.L. & Howard, S.C. Acetaminophen and Diphenhydramine Premedication for Allergic and Febrile Nonhemolytic Transfusion Reactions: Good Prophylaxis or Bad Practice? Transfusion medicine reviews 21, 1-12 (2007).
- Roubinian, N. TACO and TRALI: biology, risk factors, and prevention strategies. Hematology 2018, 585-594 (2018).
- Bulle, E.B., Klanderman, R.B., Pendergrast, J., et al. The recipe for TACO: A narrative review on the pathophysiology and potential mitigation strategies of transfusion-associated circulatory overload. Blood reviews 52, 100891 (2022).
- Choosing Wisely Canada. Ten tests and treatments to question in transfusion medicine. Vol. 2022 (Choosing Wisely Canada,, 2021).
- National Advisory Committee on Blood and Blood Products. Recommendations for use of irradiated blood components in Canada: A NAC and CCNMT collaborative initiative. (2018).
- Cohen, R., Escorcia, A., Tasmin, F., et al. Feeling the burn: the significant burden of febrile nonhemolytic transfusion reactions. Transfusion 57, 1674-1683 (2017).
- Wang, S.E., Lara, P.N., Jr., Lee-Ow, A., et al. Acetaminophen and diphenhydramine as premedication for platelet transfusions: a prospective randomized double-blind placebo-controlled trial. Am J Hematol 70, 191-194 (2002).
- Panch, S.R., Montemayor-Garcia, C. & Klein, H.G. Hemolytic Transfusion Reactions. New England Journal of Medicine 381, 150-162 (2019).
- Marconi, M., Langeberg, A.F., Sirchia, G., et al. Improving transfusion safety by electronic identification of patients, blood samples, and blood units. Immunohematology / American Red Cross 16, 82-85 (2000).
- Ramirez-Arcos, S., Evans, S., McIntyre, T., et al. Extension of platelet shelf life with an improved bacterial testing algorithm. Transfusion 60, 2918-2928 (2020).
- Ramirez-Arcos, S., DiFranco, C., McIntyre, T., et al. Residual risk of bacterial contamination of platelets: six years of experience with sterility testing. Transfusion 57, 2174-2181 (2017).
- Palavecino, E.L., Yomtovian, R.A. & Jacobs, M.R. Bacterial contamination of platelets. Transfusion and apheresis science: Official journal of the World Apheresis Association: Official journal of the European Society for Haemapheresis 42, 71-82 (2010).
- Semple, J.W., Rebetz, J. & Kapur, R. Transfusion-associated circulatory overload and transfusion-related acute lung injury. Blood 133, 1840-1853 (2019).
- Schipperus, M.R., Wiersum-Osselton, J.C. & Group, O.B.o.t.I.-I.-A.T.D.R. Updated definitions for respiratory complications of blood transfusion. Transfusion 59, 2482-2483 (2019).
- Vlaar, A.P.J., Toy, P., Fung, M., et al. A consensus redefinition of transfusion-related acute lung injury. Transfusion 59, 2465-2476 (2019).
- Badami, K.G., Joliffe, E. & Stephens, M. Transfusion-associated dyspnoea – shadow or substance? Vox Sanguinis 109, 197-200 (2015).
- Centers for Disease Control and Prevention. National Healthcare Safety Network Biovigilance Component Hemovigilance Module Surveillance Protocol. (Atlanta, GA, 2021).
- Hirayama, F. Current understanding of allergic transfusion reactions: incidence, pathogenesis, laboratory tests, prevention and treatment. British Journal of Haematology 160, 434-444 (2013).
- Khandelwal, A., Clarke, G., Goldman, M. Anaphylactic transfusion reactions and IgA deficiency (Canadian Blood Services, Ottawa, 2021).
- Ching, J.C.Y., Lau, W., Hannach, B., et al. Peanut and fish allergy due to platelet transfusion in a child. CMAJ : Canadian Medical Association Journal 187, 905-907 (2015).
- Adkins, B.D., Lawicki, S., Johnson, M., et al. Mild Allergic Transfusion Reactions: Impact of Associated Clinical Symptoms? American Journal of Clinical Pathology 151, 344-348 (2019).
- Kennedy, L.D., Case, L.D., Hurd, D.D., et al. A prospective, randomized, double-blind controlled trial of acetaminophen and diphenhydramine pretransfusion medication versus placebo for the prevention of transfusion reactions. Transfusion 48, 2285-2291 (2008).
- Sandler, S.G., Eder, A.F., Goldman, M., et al. The entity of immunoglobulin A-related anaphylactic transfusion reactions is not evidence based. Transfusion 55, 199-204 (2015).
- Sampson, H.A., Muñoz-Furlong, A., Campbell, R.L., et al. Second symposium on the definition and management of anaphylaxis: Summary report—Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. Journal of Allergy and Clinical Immunology 117, 391-397 (2006).
- Schmidt, A.P., Taswell, H.F. & Gleich, G.J. Anaphylactic Transfusion Reactions Associated with Anti-IgA Antibody. New England Journal of Medicine 280, 188-193 (1969).
- Shimada, E., Tadokoro, K., Watanabe, Y., et al. Anaphylactic transfusion reactions in haptoglobin-deficient patients with IgE and IgG haptoglobin antibodies. Transfusion 42, 766-773 (2002).
- Arnold, D.M., Blajchman, M.A., DiTomasso, J., et al. Passive Transfer of Peanut Hypersensitivity by Fresh Frozen Plasma. Archives of Internal Medicine 167, 853-854 (2007).
- Jacobs, J.F.M., Baumert, J.L., Brons, P.P., et al. Anaphylaxis from passive transfer of peanut allergen in a blood product. The New England Journal of Medicine 364, 1981-1982 (2011).
- Cyr, M., Eastlund, T., Blais, C., et al. Bradykinin metabolism and hypotensive transfusion reactions. Transfusion 41, 136-150 (2001).
- Public Health Agency of Canada. Transfusion Transmitted Injuries Surveillance System. User’s Manual. Version 3.0 (2007).
- Owen, H.G. & Brecher, M.E. Atypical reactions associated with use of angiotensin-converting enzyme inhibitors and apheresis. Transfusion 34, 891-894 (1994).
- Fried, M.R., Eastlund, T., Christie, B., et al. Hypotensive reactions to white cell-reduced plasma in a patient undergoing angiotensin-converting enzyme inhibitor therapy. Transfusion 36, 900-903 (1996).
- The Trial to Reduce Alloimmunization to Platelets Study Group. Leukocyte reduction and ultraviolet B irradiation of platelets to prevent alloimmunization and refractoriness to platelet transfusions. The New England Journal of Medicine 337, 1861-1869 (1997).
- Pineda, A.A., Vamvakas, E.C., Gorden, L.D., et al. Trends in the incidence of delayed hemolytic and delayed serologic transfusion reactions. Transfusion 39, 1097-1103 (1999).
- Compernolle, V., Chou, S.T., Tanael, S., et al. Red blood cell specifications for patients with hemoglobinopathies: a systematic review and guideline. Transfusion 58, 1555-1566 (2018).
- Gershfeld, N.L. & Murayama, M. Thermal instability of red blood cell membrane bilayers: temperature dependence of hemolysis. J Membr Biol 101, 67-72 (1988).
- Miller, M.A. & Schlueter, A.J. Transfusions via hand-held syringes and small-gauge needles as risk factors for hyperkalemia. Transfusion 44, 373-381 (2004).
- Hawkins, J., Aster, R.H. & Curtis, B.R. Post-Transfusion Purpura: Current Perspectives. Journal of Blood Medicine 10, 405-415 (2019).
- Shtalrid, M., Shvidel, L., Vorst, E., et al. Post-transfusion purpura: a challenging diagnosis. Isr Med Assoc J 8, 672-674 (2006).
- Vamvakas, E.C. & Blajchman, M.A. Transfusion-related mortality: the ongoing risks of allogeneic blood transfusion and the available strategies for their prevention. Blood 113, 3406-3417 (2009).
- Shivdasani, R.A., Haluska, F.G., Dock, N.L., et al. Graft-versus-Host Disease Associated with Transfusion of Blood from Unrelated HLA-Homozygous Donors. New England Journal of Medicine 328, 766-770 (1993).
- Kopolovic, I., Ostro, J., Tsubota, H., et al. A systematic review of transfusion-associated graft-versus-host disease. Blood 126, 406-414 (2015).
- Mykhailova, O., Turner, T.R., Olafson, C., et al. Hypothermic storage of leukoreduced red blood cells for greater than 21 days is a safe alternative to irradiation. Transfusion, 1-11 (2021).
- Hauck-Dlimi, B., Ruppel, R., Zimmermann, R., et al. Transfusion-related alloimmune neutropenia with no pulmonary complications: one donor-five cases. Transfusion 56, 84-90 (2016).
- Wallis, J.P., Haynes, S., Stark, G., et al. Transfusion-related alloimmune neutropenia: an undescribed complication of blood transfusion. Lancet 360, 1073-1074 (2002).
- Remacha, Á., Sanz, C., Contreras, E., et al. Guidelines on haemovigilance of post-transfusional iron overload. Blood Transfusion 11, 128-139 (2013).
- Kim, M.K., Lee, J.W., Baek, K.H., et al. Endocrinopathies in transfusion-associated iron overload. Clin Endocrinol (Oxf) 78, 271-277 (2013).
- Coates, T.D. Iron overload in transfusion-dependent patients. Hematology 2019, 337-344 (2019).