Chapitre 19
Plaquettes à teneur réduite en agents pathogènes
Dernière mise à jour : 24 mai 2023
Principal public cible : médecins spécialistes et non spécialistes en transfusion, personnel infirmier, technologistes médicaux travaillant dans un laboratoire d’hôpital.
Le présent chapitre entend fournir des renseignements concernant les plaquettes à teneur réduite en agents pathogènes, un composant sanguin fabriqué par la Société canadienne du sang depuis 2022. Pour désigner ce type de plaquettes, on parle également de plaquettes INTERCEPT, de plaquettes traitées par une technologie de réduction des agents pathogènes et de plaquettes traitées au psoralène. Les plaquettes mélangées traitées au psoralène (PMTP) et les plaquettes d’aphérèse traitées au psoralène (PATP) sont des sous-types particuliers de plaquettes à teneur réduite en agents pathogènes. La technologie d’inactivation des agents pathogènes (TIP) correspond aux techniques utilisées pour produire des plaquettes à teneur réduite en agents pathogènes.
Le chapitre présente des renseignements sur la fabrication des plaquettes à teneur réduite en agents pathogènes, les caractéristiques de ce composant et son innocuité, ainsi qu’une comparaison avec des plaquettes non traitées en termes de caractéristiques, d’avantages cliniques et d’inconvénients.
Introduction
Pendant le don de sang, les composants sanguins peuvent être contaminés par des bactéries présentes sur la peau des donneurs ou plus rarement dans leur circulation sanguine1, 2. Les composants plaquettaires sont davantage à risque de contamination bactérienne du fait de leur entreposage à température ambiante. De 2006 à 2016, la Société canadienne du sang a consigné des données de surveillance qui ont révélé la survenue de septicémie bactérienne après transfusion de concentrés plaquettaires dans un rapport de 1:125 0003. En 2020, la Société canadienne du sang a détecté une contamination bactérienne réelle ou présumée dans 175 composants plaquettaires (sur 105 720)1.
Afin de réduire le risque de contamination bactérienne, un certain nombre de stratégies d’atténuation des risques ont été mises en œuvre, y compris l’introduction de sacs de diversion utilisés pendant le recueil de sang total4 (voir le chapitre 6 pour en savoir plus sur le procédé de prélèvement sanguin) et l’échantillonnage de cultures bactériennes retardées en gros volume5. À la Société canadienne du sang, les plaquettes non traitées font l’objet d’un dépistage régulier pour détecter une contamination bactérienne à l’aide de méthodes de culture microbienne du système BACT/ALERT 3D. Bien que la mise en œuvre d’un algorithme de détection bactérienne renforcée en gros volume ait permis de diviser par trois les réactions transfusionnelles septiques5, le risque de contamination bactérienne reste plus élevé que celui d’autres infections transmises par transfusion1. Pour obtenir de plus amples renseignements sur les analyses bactériologiques des plaquettes, voir notre FAQ : Analyses bactériologiques des plaquettes à la Société canadienne du sang.
En vue d’améliorer la sécurité du sang, de nombreux pays ont déployé des technologies d’inactivation des agents pathogènes afin de réduire le risque de contamination bactérienne1, 6. En décembre 2021, Santé Canada a approuvé l’utilisation de la technologie d’inactivation des agents pathogènes INTERCEPT de Cerus pour la fabrication des plaquettes mélangées traitées au psoralène (PMTP) à la Société canadienne du sang. En janvier 2022, notre organisation a introduit les PMTP dans certains hôpitaux. Suite à l’approbation de Santé Canada en mai 2023, les plaquettes d’aphérèse traitées au psoralène (PATP) et les plaquettes d’aphérèse non traitées dans la solution PAS-E ont été mises en circulation à Ottawa le 12 juin 2023 et feront ensuite l’objet d’un déploiement national (voir Lettre aux clients CL 2023-03).
Technologie d’inactivation des agents pathogènes
Les technologies d’inactivation des agents pathogènes permettent de réduire le risque de présence d’agents pathogènes transmis par transfusion et offrent une sécurité supplémentaire contre7 :
- les virus (enveloppés et non enveloppés) :
- p. ex. VIH-1, virus associé à la cellule, HTLV-I/II, virus du Nil occidental, virus Chikungunya, cytomégalovirus (CMV), virus grippal A
- les bactéries (organismes Gram positif et Gram négatif et spirochètes) :
- p. ex. Klebsiella pneumoniae, Escherichia coli, Staphylococcus aureus, Treponema pallidum (syphilis)8, Borrelia burgdorferi (maladie de Lyme)
- les parasites protozoaires :
- p. ex. Plasmodium falciparum, Babesia microti, Trypanosoma cruzi
- les globules blancs (leucocytes)
- les cellules T humaines
Mécanisme d’action
L’amotosalène S-59 (amotosalène) est le composé photoréactif actif du système d’inactivation des agents pathogènes INTERCEPT de Cerus. Il s’agit d’un psoralène synthétique qui s’intercale au sein des acides nucléiques composant l’ADN et l’ARN des organismes et des virus. Une fois ajouté au composant plaquettaire dans le cadre d’un procédé spécialisé, l’amotosalène est activé par l’illumination aux rayonnements ultraviolets (UVA, 320-400 nm), ce qui entraîne une réticulation permanente entre les brins d’acides nucléiques des virus, bactéries, protozoaires et leucocytes qui pourraient contaminer l’unité de plaquettes. La réticulation endommage l’ADN et l’ARN, inactivant ainsi les agents pathogènes et les leucocytes. L’amotosalène ne s’interpose pas de manière spécifique avec le matériel génétique d’un organisme particulier ou d’une séquence d’acides nucléiques définie. Il peut donc modifier tout matériel cellulaire disposant d’ADN ou d’ARN, y compris les plaquettes et globules blancs provenant de donneurs. L’inactivation du matériel génétique de plaquettes de donneurs n’altère pas le fonctionnement des plaquettes.
Après l’adjonction de l’amotosalène et l’illumination aux rayonnements UVA, les plaquettes sont transférées dans un sac contenant un dispositif d’adsorption du composé qui élimine les résidus d’amotosalène et ses photo-produits circulant librement. Le sac est ensuite agité pendant 16 heures maximum. Le matériel dans le dispositif d’adsorption du composé réduit la concentration d’amotosalène de 150 µmol/l à 0,5 µmol/l post-adsorption9.
Efficacité
L’amotosalène a été étudié avec des virus enveloppés et non enveloppés, des bactéries Gram positif et Gram négatif et des parasites. La charge infectieuse est mesurée en tant que réduction logarithmique par rapport à l’inoculum dopé initial. L’efficacité est variable en fonction des pathogènes, la réduction se situant pour la plupart à un niveau supérieur à 3 log.
Tableau 1 : Efficacité de la technologie d’inactivation INTERCEPT sur les virus, les bactéries et les parasites dans une solution additive pour plaquettes.Données provenant de Cerus‡ et d’études publiées†*.
| Virus enveloppés | Réduction logarithmique | Virus non enveloppés |
Réduction logarithmique |
|---|---|---|---|
| VIH-1, acellulaire VIH-1, associé à la cellule VHB VHC HTLV-I HTLV-II Cytomégalovirus Virus de la diarrhée virale bovine† Virus du Nil occidental Virus Chikungunya Virus grippal A Virus SARS-CoV-2* Virus de la dengue† Virus de la fièvre hémorragique de Crimée-Congo† |
≥5,6 ≥5,4 ≥4,8 ≥4,1 4,7 ≥5,1 ≥4,9 >6,0 ≥6,3 ≥5,7 ≥5,9 >3,31 >5,2 2,9 |
VHA† Parvo B19† Virus de la fièvre catarrhale du mouton Adénovirus humain Calicivirus |
0 >6,2 5,2 ≥4,9 2,1 |
| Bactéries Gram positif | Réduction logarithmique | Bactéries Gram négatif | Réduction logarithmique |
| Bacillus cereus (y compris spores) Bacillus cereus (cellules végétatives) Bifidobacterium adolescentis Clostridium perfringens (cellules végétatives) Corynebacterium minutissimum Listeria monocytogenes Proprionobacterium acnes Staphylococcus aureus Staphylococus epidermidis Streptococcus pyogenes Lactobacillus species† |
3,7 ≥5,5 ≥6,0 ≥6,5 ≥5,3 ≥6,3 ≥6,5 ≥6,6 ≥6,4 ≥6,8 >6,9 |
Escherichia coli Enterobacter cloacae Klebsiella pneumonia Pseudomonas aeruginosa Salmonella cholerasuis Serratia marsescens Yersinia enterocolitica |
>6,3 >6,6 >6,2 ≥6,7 6,2 ≥6,7 ≥5,9 |
| Parasites | Réduction logarithmique | Spirochètes | Réduction logarithmique |
| Babesia microti Leishmania major† Leishmania mexicana Plasmodium falciparum Trypanozoma cruzi |
≥4,9 >4,3 ≥5,0 ≥6,6 ≥7,8 |
Borrelia burgdorferi Treponema pallidum |
≥6,8 ≥6,4 |
|
† Schlenke P. Pathogen inactivation technologies for cellular blood components: an update. Transfus Med Hemother. 2014;41(4):309-325. * Hindawi SI, El-Kafrawy SA, Hassan AM, et al. Efficient inactivation of severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) in human apheresis platelet concentrates with amotosalen and ultraviolet A light. Transfus Clin Biol. 2022;29(1):31-36. doi:10.1016/j.tracli.2021.08.005 ‡ Site Web de Cerus : https://intercept-usa.com/what-is-intercept/intercept-platelets/broad-spectrum-pathogen-reduction/ |
|||
Des études in vitro ont montré qu’en comparaison avec l’irradiation, l’amotosalène exposé aux rayonnements UVA est efficace pour inactiver les leucocytes10, 11. D’excellents résultats en termes d’innocuité ont été rapportés dans une étude de cohorte menée sur des patients ayant reçu après une greffe de cellules souches hématopoïétiques des transfusions de plaquettes à teneur réduite en agents pathogènes qui n’étaient ni irradiées ni déleucocytées12. Les études cliniques et bases de données d’hémovigilance n’ont signalé aucun cas de maladie du greffon contre l’hôte associée à une transfusion après la transfusion de plaquettes à teneur réduite en agents pathogènes. Ces produits sont considérés équivalents aux composants irradiés et ne nécessitent en aucun cas une irradiation.
Profil d’innocuité de l’amotosalène
La toxicité des traitements à base de psoralènes a fait l’objet d’études approfondies. La quantité d’amotosalène résiduel après préparation des plaquettes est bien inférieure au seuil de toxicité. Dans les modèles murins, l’exposition néonatale de rats à de fortes concentrations d’amotosalène (jusqu’à 48 fois la dose prévue chez des patients adultes) n’a montré aucune toxicité13. La toxicité aiguë et chronique de l’amotosalène a également été évaluée dans des études avec augmentation des doses de plaquettes traitées par le système INTERCEPT et mesure des taux d’amotosalène14. Les doses ayant provoqué une toxicité aiguë dans les expérimentations animales sont 150 000 fois (chez le rat) et 30 000 fois (chez le chien) supérieures aux doses qui seraient délivrées dans le cadre d’une dose de plaquettes chez l’être humain15. Par ailleurs, l’amotosalène est hydrosoluble et rapidement excrété. Par conséquent, il n’y a pas de bioaccumulation des traces du composé dans les composants sanguins2.
L’utilisation du système INTERCEPT est approuvée dans l’Union européenne depuis 2002 et a obtenu l’homologation de la FDA aux États-Unis en 2014. Des essais cliniques ainsi que de vastes bases de données d’hémovigilance multinationales ont confirmé l’excellent profil d’innocuité observé dans les études précliniques16, 17, 18.
Fabrication et caractéristiques des plaquettes à teneur réduite en agents pathogènes
La production de plaquettes à teneur réduite en agents pathogènes, qu’il s’agisse de plaquettes mélangées traitées au psoralène (PMTP) ou de plaquettes d’aphérèse traitées au psoralène (PATP), est décrite ci-après séparément, au même titre que la fabrication de plaquettes d’aphérèse non traitées conservées dans la solution additive pour plaquettes PAS‑E – la formulation de solution additive pour plaquettes utilisées à la Société canadienne du sang.
Le tableau 2 offre un résumé des caractéristiques des deux composants plaquettaires existants (plaquettes d’aphérèse non traitées dans le plasma, plaquettes extraites de la couche leucoplaquettaire non traitées dans le plasma), ainsi que des trois nouveaux produits plaquettaires, tous en suspension dans une solution additive pour plaquettes (PMTP, PATP et plaquettes d’aphérèse non traitées dans la solution PAS-E).
Fabrication des plaquettes mélangées traitées au psoralène (PMTP)
La fabrication de PMTP débute par le recueil du sang total dans des dispositifs de prélèvement de couche leucoplaquettaire de donneurs dans un centre de collecte de la Société canadienne du sang. Les unités de sang total sont centrifugées pour être fractionnées en plasma, couche leucoplaquettaire (contenant des leucocytes et des plaquettes) et globules rouges. Les couches de globules rouges et de plasma sont extraites de la poche de prélèvement pour ne laisser que la couche leucoplaquettaire avec une faible quantité de plasma et de globules rouges (processus également appelé « méthode B1 » pour le prélèvement des couches leucoplaquettaires de sang total). Sept couches leucoplaquettaires — une de chaque unité de donneur — sont ensuite mélangées et la solution additive pour plaquettes (PAS-E) est ajoutée. Le mélange de couches leucoplaquettaires est alors centrifugé et le surnageant riche en plaquettes (comprenant le plasma résiduel et la solution PAS-E) est extrait des globules rouges restants dans les couches leucoplaquettaires via un filtre de déleucocytation préservant les plaquettes, afin de produire une unité de double dose de plaquettes mélangées.
L’amotosalène est ajouté à l’unité de double dose de plaquettes mélangées, laquelle est exposée à l’illumination aux rayonnements UVA pour faciliter la réticulation entre les acides nucléiques résiduels dans l’unité. Un traitement unique par des rayonnements UVA peut s’interposer suffisamment entre l’ADN et l’ARN des cellules des donneurs et les agents pathogènes sur une large fourchette de concentrations. Les résidus d’amotosalène et ses photo-produits sont ensuite éliminés par incubation de l’unité de double dose de plaquettes mélangées avec un dispositif d’adsorption du composé. L’unité de double dose de PMTP est alors divisée en deux unités de dose unique de PMTP.
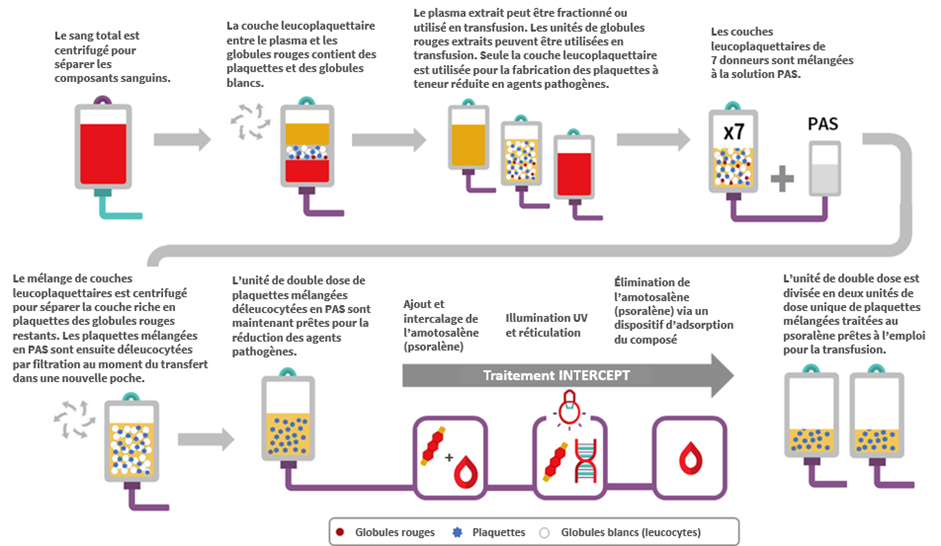
Caractéristiques des PMTP
Les plaquettes mélangées à teneur réduite en agents pathogènes sont produites à partir de couches leucoplaquettaires de sept donneurs de sexe masculin ou féminin qui sont mélangées pour créer une unité de double dose qui est ensuite divisée en deux unités distinctes. En comparaison, les unités actuelles de plaquettes mélangées non traitées sont créées à partir de couches leucoplaquettaires provenant au maximum de trois donneuses et d’au moins un donneur, avec resuspension des plaquettes dans le plasma du donneur masculin. Bien que les PMTP soient dérivées de plus de donneurs (sept) que les plaquettes mélangées non traitées (quatre), le volume total de plasma par unité de PMTP est inférieur à celui d’une unité de plaquettes mélangées non traitées. En effet, le produit de PMTP est mélangé dans la solution additive pour plaquettes PAS-E et non dans le plasma du donneur masculin (le rapport entre plasma et solution PAS-E est d’environ 40 % pour 60 %). Se reporter au tableau 2 pour un résumé des caractéristiques du produit. Il convient de noter le rendement plaquettaire inférieur et les différences au niveau du volume et de la numération plaquettaire moyenne entre les PMTP et les plaquettes mélangées non traitées.
Le nombre de globules blancs résiduels post-filtration dans une unité de double dose de PMTP est de 0,04 ± 0,06 x 106 cellules par unité, ce qui est comparable au nombre de globules blancs résiduels post-filtration dans un produit de plaquettes mélangées non traitées dans le plasma (0,04 ± 0,09 x 106 cellules par unité). Par ailleurs, le faible nombre de globules blancs résiduels dans les PMTP est inactivé par l’amotosalène et les rayonnements UVA.
Fabrication des plaquettes d’aphérèse traitées au psoralène (PATP) et des plaquettes d’aphérèse non traitées dans la solution additive pour plaquettes PAS-E
La fabrication de PATP débute par le don de plaquettes par aphérèse d’un donneur unique effectué dans un centre de collecte de la Société canadienne du sang. Contrairement au prélèvement de sang total, la thrombocytaphérèse est réalisée à l’aide de l’appareil d’aphérèse Trima de Terumo qui extrait les plaquettes et le plasma du donneur du sang total. Chaque prélèvement produit une unité d’une seule dose de plaquettes ou une unité de double dose. Les plaquettes sont déleucocytées à l’aide du système Trima durant le prélèvement sous une forme hyperconcentrée avec une faible quantité de plasma. La solution additive pour plaquettes est ensuite ajoutée pour obtenir le ratio entre PAS-E et plasma souhaité (environ 60:40) pour chaque unité de plaquettes. Les unités de dose unique de plaquettes d’aphérèse qui en résultent sont ensuite toutes soumises à un processus d’inactivation des agents pathogènes avec adjonction de l’amotosalène et illumination aux rayonnements UVA, comme c’est le cas pour les PMTP. Les résidus d’amotosalène sont éliminés par incubation de l’unité avec un dispositif d’adsorption du composé avant que les unités soient prêtes à l’emploi.
La fabrication de plaquettes d’aphérèse non traitées dans la solution PAS-E est similaire à celle de PATP, hormis l’inactivation des agents pathogènes qui n’a pas lieu (pas de traitement à l’amotosalène ni d’exposition aux rayonnements UVA). Après la fabrication, il faudrait mener les tests routiniers de stérilité qui sont effectués sur nos plaquettes d’aphérèse dans le plasma à l’aide du système BacT/ALERT (voir la FAQ sur le dépistage bactériologique des plaquettes à la Société canadienne du sang).
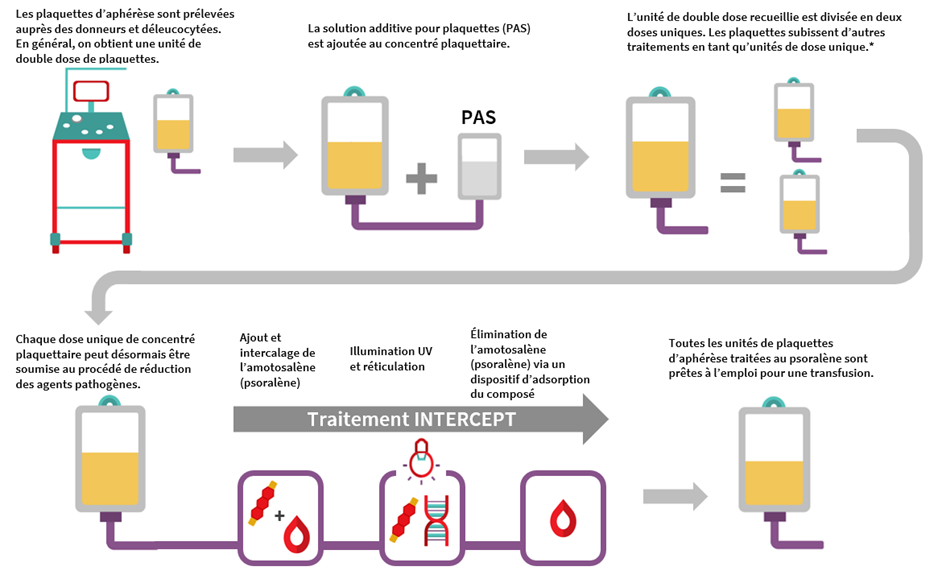
* À ce stade du procédé de fabrication, les unités utilisées pour produire les plaquettes d’aphérèse dans la solution PAS-E non traitées sont transmises pour des analyses bactériologiques; elles ne sont pas soumises à une réduction des agents pathogènes
Caractéristiques des PATP et des plaquettes d’aphérèse non traitées conservées dans la solution PAS-E
Les PATP et les plaquettes d’aphérèse non traitées dans la solution PAS-E sont fabriquées à partir de donneurs individuels de sexe masculin ou féminin. En général, le prélèvement permet de fabriquer une unité de double dose de plaquettes, même s’il peut également aboutir à une unité de dose unique. Il n’y a pas de mélange avec d’autres donneurs. Se reporter au tableau 2 pour un résumé des caractéristiques du produit. Il convient de noter les différences au niveau du volume, de la numération plaquettaire moyenne et du rendement plaquettaire des PATP et des plaquettes d’aphérèse non traitées dans la solution PAS-E par rapport aux plaquettes d’aphérèse non traitées dans le plasma. N’oubliez pas que les valeurs indiquées sont uniquement des données provenant du développement du produit et pourraient changer après validation et mise en circulation du composant.
Le nombre de globules blancs résiduels post-déleucocytation pour un produit de plaquettes d’aphérèse dans la solution PAS-E est d’environ 0,04 x 106 cellules par unité, contre 0,09 ± 0,22 x 106 cellules par unité dans un produit de plaquettes d’aphérèse non traitées dans le plasma. Par ailleurs le faible nombre de globules blancs résiduels dans les PATP est inactivé par l’amotosalène.
Conditionnement et étiquetage
Les PMTP et les PATP sont conservées dans des poches en éthylène/acétate de vinyle perméables au gaz. Les plaquettes d’aphérèse non traitées dans la solution PAS-E sont conservées dans des poches en polychlorure de vinyle n-butyryl-tri-n-hexyl citrate (PVC-BTHC). Ces poches ne sont pas plastifiées au phtalate de bis(2-éthylhexyle) (DEHP); cependant, les orifices de sortie et la tubulure pour la transfusion peuvent avoir des éléments en plastique contenant du DEHP. Les unités de plaquettes peuvent également entrer en contact avec un plastifiant au DEHP pendant les processus de prélèvement du sang et de fabrication du composant.

Poches de plaquettes mélangées non traitées (à gauche) et de plaquettes mélangées traitées au psoralène (PMTP) (à droite). Les poches de PMTP sont plus grandes (31 x 18 cm) que les poches utilisées pour les plaquettes mélangées non traitées dans le plasma (30 x 15 cm). En plus de deux orifices de sortie pour transfusion, la poche de plaquettes mélangées non traitées dans le plasma vient avec des tubes en queue de cochon, dont l’un peut être utilisé pour l’échantillonnage, alors que la nouvelle poche de PMTP dispose d’un système d’échantillonnage intégré à la place du tube en queue de cochon. Les plaquettes mélangées non traitées dans le plasma (à gauche) sont plus foncées du fait de la teneur supérieure en plasma.
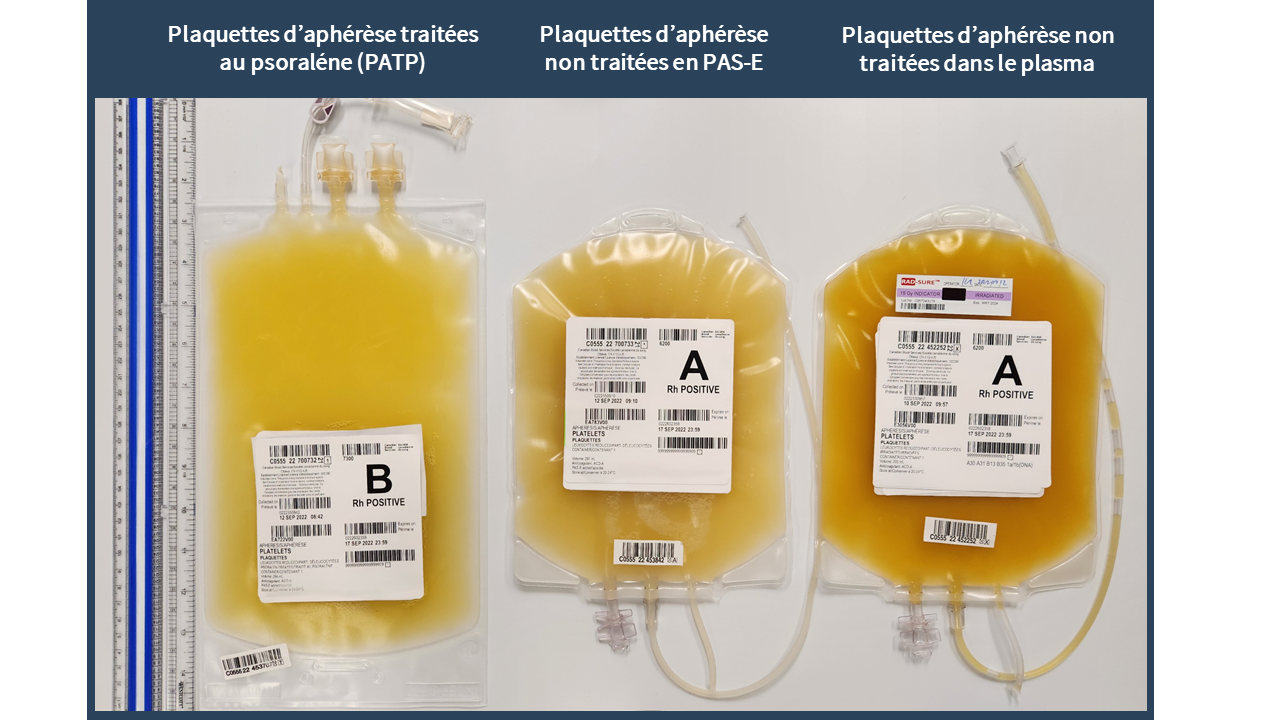
Plaquettes d’aphérèse traitées au psoralène (PATP) (à gauche), plaquettes d’aphérèse non traitées dans la solution PAS-E (au centre), plaquettes d’aphérèse non traitées dans le plasma (à droite). Les poches de PATP (32 x 18 cm) sont plus grandes que celles utilisées pour les plaquettes d’aphérèse non traitées dans le plasma et dans la solution PAS-E (24 cm x 17 cm). En plus de deux orifices de sortie pour transfusion, les nouvelles poches de PATP disposent d’un système d’échantillonnage intégré à la place du tube en queue de cochon. La taille des poches et la tubulure sont identiques pour les plaquettes d’aphérèse non traitées dans la solution PAS-E et celles dans le plasma. Les plaquettes d’aphérèse non traitées dans le plasma (à droite) sont plus foncées du fait de la teneur supérieure en plasma.
Des exemples d’étiquettes d’unités de PMTP, PATP et de plaquettes d’aphérèse non traitées en solution PAS-E sont fournis ci-après. Les codes-produit et d’autres exemples d’étiquettes sont fournis dans les lettres aux clients 2022-18 et 2022-34. Pour obtenir d’autres exemples d’étiquettes, n’hésitez pas à contacter votre agent de liaison de la Société canadienne du sang.




Tableau 2 : Résumé des caractéristiques des composants plaquettaires existants et nouveaux
| Anciens composants plaquettaires dans le plasma (avant 2022) | Nouveaux composants plaquettaires dans PAS-E (à compter de 2022) | ||||
|---|---|---|---|---|---|
| Non traités (à teneur non réduite en agents pathogènes) | À teneur réduite en agents pathogènes | ||||
| Caractéristique du composant | Plaquettes mélangées non traitées | Plaquettes d'aphérèse non traitées | Plaquettes d’aphérèse non traitées dans PAS-E | Plaquettes d'aphérèse traitées au psoralène | Plaquettes mélangées traitées au psoralène (PMTP) |
| Volume unitaire moyen (mL) | 317 | 223 | 269 | 277 | 184 |
| Nombre de donneurs dans le composant | 4 | 1 | 1 | 1 | 7‡ |
| Volume plasmatique moyen (mL) | 317 (environ 20 ml de trois donneuses + 257 ml de plasma d’un donneur masculin) | 173 | 113* | 116 | 75 (environ 11 ml par donneur) |
| Nombre de plaquettes approximatif (x109 plaquettes par litre) | 1 069 | 1 493 | 1 033 | 909 | 1363 |
| Rendement plaquettaire approximatif (x109 plaquettes par unité) | 339 | 333 | 279 | 252 | 251 |
| Solution de resuspension | Plasma | Plasma |
Environ 60 % de solution additive pour plaquettes (PAS-E) + |
Environ 60 % de solution additive pour plaquettes (PAS-E) + |
Environ 60 % de solution additive pour plaquettes (PAS-E) + |
| Anticoagulant | CPD | ACD-A | ACD-A | ACD-A | CPD |
| Dépistage bactérien effectué par la Société canadienne du sang | Oui | Oui | Oui | Non | Non |
| Délai typique entre le prélèvement de sang des donneurs et la délivrance du composant à l'hôpital | Jour 3 | Jour 3 | Jour 3 | Jour 2 | Jour 2 |
| Durée de conservation du composant (à partir du prélèvement de sang) | 7 jours | 7 jours | 7 jours** | 7 jours | 7 jours** |
| Présence de lymphocytes viables | Oui, irradiation requise¥ pour les patients vulnérables | Oui, irradiation requise¥ pour les patients vulnérables | Oui, irradiation requise¥ pour les patients vulnérables | Absence de lymphocytes viables, irradiation non requise pour les patients vulnérables | Absence de lymphocytes viables, irradiation non requise pour les patients vulnérables |
|
Remarque : Les caractéristiques des plaquettes mélangées et des plaquettes d’aphérèse non traitées dans le plasma sont décrites dans la circulaire d’information de la Société canadienne du sang sur les plaquettes.19 Les caractéristiques des PMTP, PATP et plaquettes d’aphérèse non traitées dans la solution PAS-E sont précisées dans les circulaires d’information de la Société canadienne du sang3. ‡ Les mélanges de plaquettes traitées au psoralène sont fabriqués à partir de couches leucoplaquettaires de sept donneurs (hommes ou femmes), qui sont mélangées, puis divisées en deux unités aux fins de transfusion. À noter que le rendement plaquettaire des mélanges de plaquettes traitées au psoralène est inférieur à celui des plaquettes mélangées non traitées. ** La durée de conservation des PMTP est passée de 5 à 7 jours le 24 avril 2023. ¥ Se reporter aux Recommandations sur l’utilisation de produits sanguins irradiés au Canada du Comité consultatif national sur le sang et les produits sanguins. |
|||||
Solution additive pour plaquettes (PAS)
La solution additive pour plaquettes est un milieu nutritif crystalloïde conçu pour remplacer une partie du plasma dans les unités de plaquettes. La solution PAS-E (la formulation de solution additive pour plaquettes utilisée à la Société canadienne du sang) est ajoutée aux PMTP, PATP et plaquettes non traitées conservées dans la PAS-E (voir figures 1 et 2).
La Société canadienne du sang utilise la solution SSP+ (PAS-E) de Macopharma pour la suspension des plaquettes avant le traitement par le système INTERCEPT. Cette solution contient 3,18 g de citrate de sodium dihydraté, 4,42 g d’acétate de sodium trihydraté, 1,05 g de dihydrogénophosphate de sodium dihydraté, 3,05 g de phosphate disodique anhydre, 0,37 g de chlorure de potassium, 0,30 g de chlorure de magnésium hexahydraté, 0,37 g de chlorure de sodium et 4,05 g de chlorure de sodium pour 1 000 ml d’eau. Elle est relativement inerte par rapport au plasma. Le ratio final entre la solution PAS-E et le plasma dans les PMTP, PATP et plaquettes d’aphérèse non traitées dans la solution PAS-E est de 60:40 environ.
Données cliniques concernant la solution additive pour plaquettes
La solution additive pour plaquettes présente de nombreux avantages en tant qu’alternative au plasma pour la suspension des plaquettes du fait de la dilution des protéines plasmatiques, des cytokines, des isoagglutinines et d’autres molécules bioactives dans le produit plaquettaire. Selon des études cliniques20-23 et des bases de données d’hémovigilance, les plaquettes conservées dans la solution additive pour plaquettes ont environ 50 % moins de risque d’entraîner des réactions transfusionnelles allergiques par rapport aux plaquettes conservées dans le plasma24, 25. Dans certaines études, les plaquettes dans la solution additive ont été associées à un risque inférieur de réactions transfusionnelles fébriles non hémolytiques22, 25. Chez les donneurs positifs aux anticorps anti-HLA, ce produit pourrait en théorie réduire le risque de syndrome respiratoire aigu post-transfusionnel (TRALI), étant moins spécifique aux anticorps anti-HLA que les plaquettes en suspension dans le plasma26, 20, 27. Néanmoins, la faible incidence de TRALI et la mise en œuvre d’autres stratégies d’atténuation des risques pour ce type de réactions ne permet pas de déterminer si et dans quelle mesure la solution additive pour plaquettes a des effets sur la survenue de TRALI20.
Le remplacement du plasma par la solution additive pour plaquettes réduit la quantité d’isoagglutinines anti-A, anti-B et anti-AB. Une réduction de 50 % des titres d’isoagglutinines a été rapportée dans les plaquettes conservées dans la solution additive pour plaquettes par rapport à celles en suspension dans le plasma26, 28, 29. Dans une étude prospective, 356 plaquettes conservées dans la solution additive pour plaquettes ont présenté des titres d’anticorps anti-A et anti-B inférieurs ou égaux à 1:32, et la plupart des unités avaient des titres inférieurs à 1:8. Les plaquettes avec incompatibilité ABO ont pu être transfusées sans problème dans cette étude30. Il n’y a pas de titres critiques d’anticorps anti-A/B largement acceptés qui permettent de prédire de manière systématique une hémolyse significative sur le plan clinique31. En outre, le risque de réactions transfusionnelles hémolytiques est plus complexe que le seul niveau des titres32. Par conséquent, la solution additive pour plaquettes pourrait en théorie améliorer la sécurité des transfusions plaquettaires incompatibles avec des effets éventuels sur les stocks et le gaspillage29. À l’heure actuelle, la Société canadienne du sang ne peut faire valoir aucun résultat concernant les titres finaux des anticorps. Des cas de réactions transfusionnelles hémolytiques suivant la transfusion de plaquettes conservées dans la solution additive pour plaquettes ont été signalés33.
S’agissant du risque de saignement, les plaquettes suspendues dans les anciennes formulations de la solution additive pour plaquettes ont entraîné des augmentations de la numération plaquettaire post-transfusionnelle plus faibles que les produits dans le plasma21, 34, 35. Des formulations plus récentes de solution additive pour plaquettes (comme la solution PAS-E utilisée par la Société canadienne du sang) ont montré une amélioration des augmentations de la numération plaquettaire entre 1 et 24 heures après la transfusion par rapport aux anciennes formulations36. Les essais cliniques n’ont révélé aucune différence en termes de complications hémorragiques et d’intervalles entre les transfusions entre les plaquettes suspendues dans une solution additive pour plaquettes et celles suspendues dans le plasma35.
Avantages
Les plaquettes à teneur réduite en agents pathogènes sont associées aux multiples avantages suivants.
Réduction du risque de transmission bactérienne
L’inactivation des agents pathogènes dans les composants plaquettaires réduit significativement le risque d’infections bactériennes transmises par transfusion37, 38. Des données d’hémovigilance en Suisse pour la période 2011-2016 après le déploiement de plaquettes à teneur réduite en agents pathogènes n’ont révélé aucun cas d’infection bactérienne transmise par transfusion (sur 205 574 composants plaquettaires délivrés)18. À l’inverse, entre 2005 et 2011, c’est-à-dire avant la mise en œuvre de la réduction des agents pathogènes, il y avait eu 16 cas d’infections bactériennes liées à des transfusions (sur 158 502 composants plaquettaires délivrés). Une étude prospective d’hémovigilance évaluant 19 175 transfusions de plaquettes à teneur réduite en agents pathogènes dans onze pays européens n’a mis en évidence aucun cas d’infection bactérienne post-transfusionnelle, ce qui vient encore appuyer l’efficacité et la sécurité de la technologie d’inactivation des pathogènes17.
Réduction du risque d’autres infections transmises par transfusion
Dans la mesure où l’amotosalène s’intercale de manière non spécifique dans l’ADN et l’ARN d’organismes et de virus, la technologie d’inactivation des agents pathogènes est une mesure supplémentaire pour renforcer la sécurité des composants plaquettaires face à des agents pathogènes connus et inconnus. Ce procédé vient compléter les critères de sélection des donneurs et les épreuves prétransfusionnelles de détection des agents pathogènes qui sont réalisées pour tous les dons (voir le chapitre 6 du Guide de la pratique transfusionnelle). Les tests de dépistage de maladies infectieuses continueront de faire partie du processus de sélection des donneurs de sang de la Société canadienne du sang, mais les analyses bactériologiques effectuées avec le système BACT/ALERT 3D ne seront en revanche pas nécessaires pour les plaquettes à teneur réduite en agents pathogènes.
L’efficacité de l’inactivation des agents pathogènes par l’amotosalène est variable selon les organismes. Certains agents pathogènes sont ainsi résistants au traitement à base d’amotosalène : il s’agit par exemple des virus des hépatites A et E, du poliovirus et des prions7. L’efficacité de l’inactivation des agents pathogènes peut être compromise par une forte charge pathogène, une mauvaise illumination du fait de substances interférentes ou une éventuelle erreur humaine pendant le traitement du sang39, 38.
Profil d’innocuité favorable
Les critères d’évaluation de l’innocuité dans les essais cliniques et les données d’hémovigilance publiées n’ont fait état d’aucun changement statistiquement significatif au niveau des réactions indésirables graves, y compris thromboembolie et anaphylaxie (risque relatif de 1,09 [0,88-1,35]), réactions transfusionnelles aiguës (risque relatif de 0,96 [0,75-1,24]) ou autres réactions indésirables (risque relatif de 1,01 [0,97-1,05]) par rapport aux plaquettes non traitées16, 17. Les solutions de conservation (solution additive pour plaquettes ou plasma) utilisées ainsi que la méthode de prélèvement des plaquettes (aphérèse ou mélangées) étaient variables dans les différentes études incluses. Après la dernière évaluation Cochrane menée en 2017, un essai randomisé comparant les plaquettes à teneur réduite en agents pathogènes et les plaquettes non traitées dans une solution additive pour plaquettes avec des plaquettes non traitées dans du plasma a mis en évidence un taux supérieur de réactions transfusionnelles allergiques survenant avec les plaquettes non traitées40. En Suisse, les données nationales d’hémovigilance portant sur plus de 200 000 concentrés plaquettaires traités par INTERCEPT (2011-2016) ont montré un profil d’innocuité similaire et une réduction des réactions engageant le pronostic vital et d’issue fatale et des réactions à forte imputabilité après la mise en circulation des plaquettes à teneur réduite en agents pathogènes18. Les auteurs ont noté que ces résultats allaient de pair avec une baisse des réactions allergiques post-transfusionnelles, probablement du fait de la teneur inférieure en plasma des plaquettes ayant subi une réduction des agents pathogènes. Une étude prospective d’hémovigilance sur les plaquettes INTERCEPT menée pendant plus de sept ans dans onze pays européens a mis en avant un excellent profil d’innocuité, comparable à celui des plaquettes non traitées17.
S’agissant des problèmes respiratoires, un essai précoce randomisé et contrôlé (SPRINT) dans le cadre duquel 645 patients atteints de thrombocytopénie ont été répartis de manière aléatoire pour recevoir des transfusions de plaquettes INTERCEPT ou de plaquettes non traitées, a suggéré un risque de syndrome de détresse respiratoire aiguë (5 sur 318 pour les plaquettes INTERCEPT contre 0 sur 327 pour les plaquettes non traitées). Une analyse secondaire des données n’a révélé aucune différence entre les deux groupes41. Plus récemment, une étude de pharmacovigilance de phase IV, l’essai PIPER, a évalué les transfusions de plaquettes chez des patients atteints de cancer hématologique sur 15 sites aux États-Unis. L’étude portait sur 2 291 patients (9 % étaient âgés de moins de 18 ans) ayant reçu plus de 10 000 transfusions de plaquettes. Aucune différence en termes de ventilation artificielle ou d’atteinte pulmonaire survenant pendant le traitement n’a été mise en évidence entre les transfusions de plaquettes à teneur réduite en agents pathogènes et celles de plaquettes non traitées. De même, aucune différence significative n’a été détectée pour les cas de syndrome de détresse respiratoire aiguë ou de réactions indésirables42.Par ailleurs, les données d’hémovigilance suisses n’ont pas permis de mettre en évidence une différence au niveau du risque de TRALI, celui-ci se situant à 1 pour 31 000 pour les plaquettes non traitées et à 1 pour 33 000 pour les plaquettes à teneur réduite en agents pathogènes43.
Les essais randomisés précédemment publiés incluaient de faibles nombres de patients pédiatriques44-47. L’innocuité et l’efficacité des plaquettes à teneur réduite en agents pathogènes ont été davantage étudiées chez l’enfant48-52 dans le cadre d’études rétrospectives et d’hémovigilance53. Schulz et ses collègues ont rapporté une évaluation du contrôle de l’innocuité concernant l’utilisation des produits plaquettaires à teneur réduite en agents pathogènes dans une cohorte de 240 patients pédiatriques, y compris en unité néonatale de soins intensifs, ayant reçu 1 932 transfusions de plaquettes (45 % non traitées et 55 % à teneur réduite en agents pathogènes)49. Aucune différence au niveau des réactions indésirables, des réactions transfusionnelles et des transfusions de globules rouges n’a été signalée. Une étude multinationale menée chez plus de 3 800 patients pédiatriques ayant reçu plus de 7 900 transfusions plaquettaires sur une période de sept ans n’a signalé aucune augmentation des réactions transfusionnelles indésirables par rapport aux plaquettes traditionnelles, et a révélé une réduction de l’incidence des réactions transfusionnelles allergiques48. En France, les données nationales d’hémovigilance portant sur plus d’un millier de nouveau-nés et d’enfants ont également suggéré l’innocuité des plaquettes à teneur réduite en agents pathogènes chez les patients pédiatriques53.
Inactivation des globules blancs
L’inhibition de la réplication leucocytaire et de la production des cytokines constitue également un avantage majeur, car cela simplifie la gestion des stocks et le processus de commande des plaquettes. Sachant que le traitement par l’amotosalène prévient la prolifération des cellules T, il n’est plus nécessaire d’irradier les produits plaquettaires à teneur réduite en agents pathogènes pour éviter les cas de maladie du greffon contre l’hôte associée à une transfusion54. De même, des composants sanguins négatifs au cytomégalovirus (CMV) (dont l’utilisation est à l’heure actuelle exclusivement limitée aux transfusions intra-utérines) sont inutiles, car les plaquettes à teneur réduite en agents pathogènes sont considérées comme un produit CMV-négatif55. Pour de plus amples informations sur la réduction du risque de CMV transmis par transfusion, consulter les recommandations et documents de formation du Comité consultatif national sur le sang et les produits sanguins.
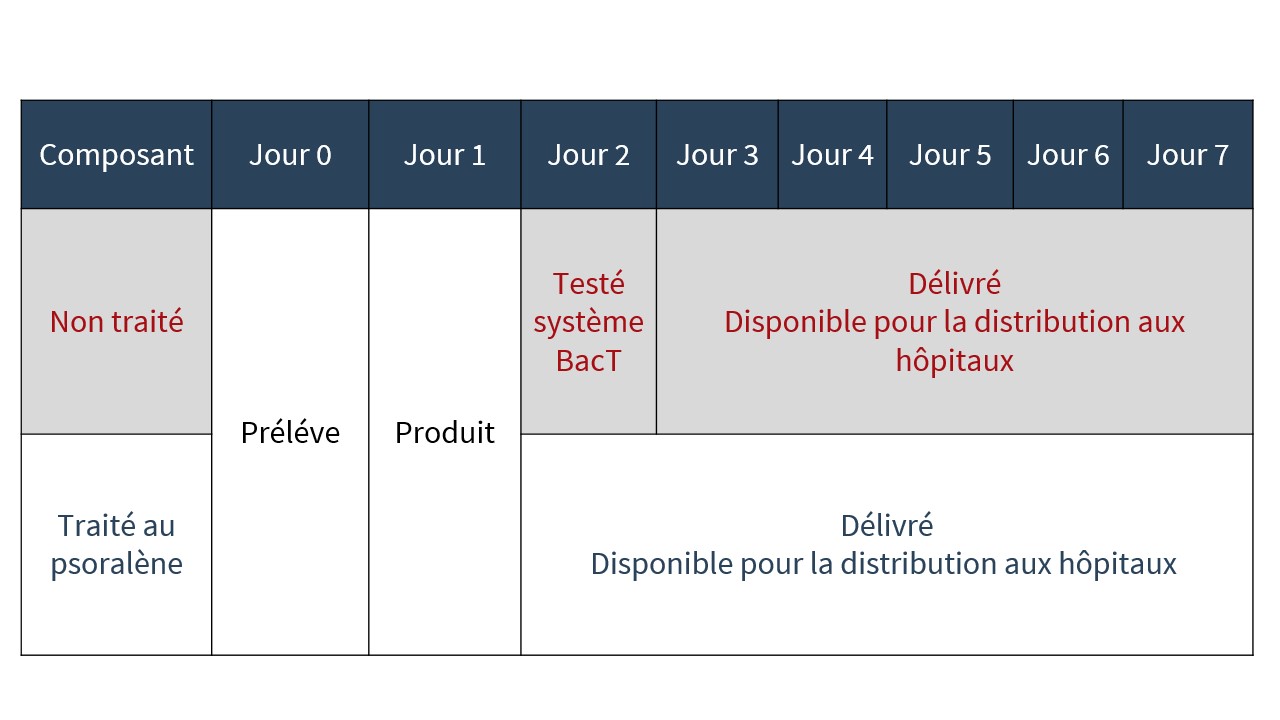
Délais d’approvisionnement
Sachant que la technologie d’inactivation des agents pathogènes élimine la nécessité de soumettre les plaquettes aux analyses bactériologiques qui sont actuellement réalisées pour les plaquettes non traitées, les plaquettes à teneur réduite en agents pathogènes sont délivrées aux hôpitaux environ 24 heures plus tôt dans leur durée de conservation que les plaquettes non traitées (voir figure 4).
Inconvénients
Augmentation de la numération plaquettaire et besoins de transfusions
La majorité des essais cliniques utilisant des plaquettes à teneur réduite en agents pathogènes ont essentiellement porté sur des patients adultes atteints d’un cancer hématologique. Dans les essais examinant le système INTERCEPT, les types de plaquettes (p. ex. plasma uniquement, solution additive pour plaquettes, différentes formulations de solution additive pour plaquettes, plaquettes mélangées, plaquettes d’aphérèse) et les rendements plaquettaires étaient variables. De manière générale, on a observé une réduction statistiquement significative de l’augmentation de la numération plaquettaire post-transfusionnelle après une heure et 24 heures, une hausse du nombre de transfusions de plaquettes et un raccourcissement de l’intervalle entre les transfusions chez les patients ayant reçu des plaquettes à teneur réduite en agents pathogènes, par rapport à ceux ayant reçu des plaquettes non traitées16, 40, 42. Néanmoins, il s’agissait de différences limitées. Dans une évaluation de Cochrane datant de 2017, la différence moyenne au niveau du nombre de transfusions de plaquettes nécessaires par patient était de 1,30 (IC à 95 % : 0,84 à 1,77, p < 0,001, I2 = 49 %). Les différences au niveau de l’augmentation de la numération plaquettaire post-transfusionnelle sur 24 heures et de l’intervalle entre les transfusions étaient en moyenne de -3,5 (IC à 95 % : -4,18 à -2,82, p < 0,0001, I2 = 0 %) et de -0,50 jour (IC à 95 % : -0,61 à -0.38, p < 0,001, I2 = 0 %), respectivement. Fait essentiel, aucune différence n’a pu être détectée en termes de saignements cliniquement significatifs (grade 2 ou plus selon l’OMS) entre les plaquettes à teneur réduite en agents pathogènes et les plaquettes non traitées16. La baisse de l’augmentation de la numération plaquettaire post-transfusionnelle semblait être multifactorielle, résultant d’un nombre de plaquettes réduit par unité transfusée et d’une hausse de l’activation plaquettaire pendant la fabrication56.
État réfractaire aux plaquettes
Un état réfractaire aux plaquettes, défini de manière différente en fonction des essais cliniques, a été signalé plus fréquemment chez les patients ayant reçu des transfusions de plaquettes à teneur réduite en agents pathogènes que chez ceux ayant reçu des plaquettes non traitées. On ne sait pas encore très bien si cet état réfractaire est dû à des causes non immunitaires ou à une allo-immunisation57. Des études antérieures de petite envergure ont suggéré que les plaquettes à teneur réduite en agents pathogènes pouvaient augmenter le risque d’allo-immunisation16. Cependant, un vaste essai contrôlé randomisé (SPRINT) où 645 patients atteints de thrombocytopénie ont été répartis de manière aléatoire pour recevoir des transfusions de plaquettes INTERCEPT ou de plaquettes non traitées, n’a mis en évidence aucune différence significative au niveau de l’allo-immunisation anti-HLA ou d’anticorps spécifiques aux plaquettes entre les groupes de l’étude, alors même que le groupe INTERCEPT a dû recevoir plus de transfusions44. De plus, chez les patients ayant développé un état réfractaire, les anticorps lymphocytotoxiques étaient significativement plus courants dans le groupe ayant reçu des transfusions de plaquettes non traitées. Une analyse secondaire de l’essai randomisé IPTAS (Italian Platelet Technology Assessment Study) n’était pas suffisamment puissante pour donner des éléments de réponse à ce sujet. Les patients ont été évalués pour détecter la présence d’anticorps anti-HLA avant et après la transfusion de plaquettes à teneur réduite en agents pathogènes ou de plaquettes non traitées. Aucune différence statistiquement significative n’a été observée au niveau des taux d’allo-immunisation anti-HLA58. De manière générale, les données probantes disponibles à ce jour suggèrent que l’état réfractaire aux plaquettes après une transfusion de produits à teneur réduite en agents pathogènes est davantage lié à des causes non immunitaires et peut probablement être surmonté par des transfusions de plaquettes supplémentaires.
Hypersensibilité à l’amotosalène et activation liée à certains appareils de photothérapie
Les plaquettes à teneur réduite en agents pathogènes sont contre-indiquées chez les patients ayant des antécédents de réactions d’hypersensibilité à l’amotosalène ou à tout autre produit contenant un psoralène. Une autre contre-indication concerne les nouveau-nés traités par des appareils de photothérapie qui émettent une longueur d’onde d’énergie maximale inférieure à 425 nm ou une limite inférieure de la largeur de bande d’émission de moins de 375 nm, du fait du risque d’érythème résultant de l’interaction entre la lumière ultraviolette et l’amotosalène. La photothérapie à lumière bleue/verte à des longueurs d’onde maximum de 450-460 nm est la norme de soins actuelle pour le traitement de l’hyperbilirubinémie néonatale au Canada59, 60. Dans une petite cohorte de 11 patients, aucun nouveau cas de rash associé à l’utilisation concomitante de photothérapie (conformément aux paramètres de longueur d’onde recommandés) et de transfusion de plaquettes à teneur réduite en agents pathogènes n’a été constaté49, 61.
Manque de résultats à long terme pour les transfusions néonatales et intra-utérines
Depuis l’approbation des plaquettes traitées par le système INTERCEPT à l’échelle internationale, plusieurs études ont décrit l’innocuité de ces produits dans des cohortes néonatales. Amato et ses collaborateurs ont évalué 91 enfants (≤ 18 ans) et nouveau-nés (≤ 30 jours) sans constater de préjudice62. Schulz et ses collaborateurs ont évalué des nouveau-nés en unité de soins intensifs, des nourrissons de moins d’un an ne se trouvant pas en unité néonatale de soins intensifs et des enfants âgés de 1 à 18 ans. Là encore, cette étude n’a révélé aucun préjudice pour ces patients49. L’évaluation menée par Lasky et coll. sur 191 patients pédiatriques et néonataux ayant reçu 1 010 transfusions de plaquettes, dont 37 nouveau-nés ayant reçu des transfusions de plaquettes INTERCEPT et 68 patients ayant uniquement reçu des plaquettes INTERCEPT52,n’a mis en évidence aucune hausse des réactions indésirables par rapport aux plaquettes non traitées, y compris chez les patients ayant reçu une photothérapie. Delaney et ses collaborateurs ont rapporté l’absence de problèmes chez 1 188 patients de moins de 4 mois ayant reçu des plaquettes à teneur réduite en agents pathogènes. Les données d’innocuité à court terme ont ainsi démontré l’innocuité chez les nouveau-nés, même si, pour l’heure, les données à long terme restent limitées. Il n’y a pas de données probantes publiées concernant l’utilisation des plaquettes traitées par le système INTERCEPT pour les transfusions intra-utérines, contexte dans lequel les plaquettes non traitées resteront disponibles. Les plaquettes à teneur réduite en agents pathogènes sont considérées comme un produit plaquettaire possible lorsque les avantages surpassent les risques (p. ex. dans le cadre d’une crise liée à un agent pathogène émergent). Il convient d’évaluer et de peser les avantages et les risques avant d’utiliser ce produit dans de telles situations.
Ressources complémentaires
Réserves en produits plaquettaires, indications et commande
- Vous pouvez télécharger et imprimer ce document d’une page qui récapitule les différents types de produits plaquettaires disponibles, leurs indications et les procédures de commande.
632.45 KB
FAQ : Information destinée aux professionnels de la santé concernant les plaquettes à teneur réduite en agents pathogènes (PMTP)
- Cette FAQ répond aux questions entourant les composants plaquettaires traités au psoralène, y compris l’administration et l’utilisation clinique.
FAQ – Information destinée aux professionnels de la santé sur les plaquettes d’aphérèse traitées au psoralène (PATP) et les plaquettes d’aphérèse non traitées dans la solution additive pour plaquettes PAS-E
- Cette FAQ a été élaborée afin d’aider les hôpitaux dans le cadre du déploiement des plaquettes d’aphérèse traitées au psoralène (PATP) et des plaquettes d’aphérèse non traitées dans la solution additive pour plaquettes PAS-E. Ces composants, mis en circulation à Ottawa le 12 juin 2023, seront ensuite déployés à l’échelle nationale.
Présentation PowerPoint – Plaquettes à teneur réduite en agents pathogènes : informations cliniques
- Ce fichier PowerPoint peut être téléchargé et utilisé pour des présentations. Il offre aux professionnels de la santé de l’information sur les plaquettes à teneur réduite en agents pathogènes : technologie d’inactivation des agents pathogènes, fabrication et caractéristiques des produits, et sécurité. Remarque : Initialement publiée en octobre 2022, cette présentation PowerPoint a été mise à jour en avril 2023 afin de refléter le changement de durée de conservation des PMTP, qui est passé de 5 à 7 jours; puis en juillet 2023, à la suite de l’approbation par Santé Canada de la mise en production des PATP et des plaquettes d’aphérèse non traitées en solution PAS-E.
11.46 MB
Présentation PowerPoint – Plaquettes à teneur réduite en agents pathogènes : l’essentiel des données cliniques
- Ce fichier PowerPoint peut être téléchargé et utilisé pour des présentations. Offrant aux professionnels de la santé une version plus courte de l’aperçu clinique, il souligne les informations à savoir sur les plaquettes à teneur réduite en agents pathogènes. Remarque : Initialement publiée en octobre 2022, cette présentation PowerPoint a été mise à jour en avril 2023 afin de refléter le changement de durée de conservation des PMTP, qui est passé de 5 à 7 jours; puis en juillet 2023, à la suite de l’approbation par Santé Canada de la mise en production des PATP et des plaquettes d’aphérèse non traitées en solution PAS-E.
Présentation PowerPoint – Plaquettes à teneur réduite en agents pathogènes : présentation des composants
- Ce fichier PowerPoint peut être téléchargé et utilisé pour des présentations. Il donne aux professionnels de la santé un aperçu des éléments à considérer concernant l’utilisation des plaquettes à teneur réduite en agents pathogènes. Le document comprend des photos et des descriptions des composants et des étiquettes des plaquettes mélangées et d’aphérèse traitées au psoralène. Remarque : Initialement publiée en octobre 2022, cette présentation PowerPoint a été mise à jour en avril 2023 afin de refléter le changement de durée de conservation des PMTP, qui est passé de 5 à 7 jours; puis en juillet 2023, à la suite de l’approbation par Santé Canada de la mise en production des PATP et des plaquettes d’aphérèse non traitées en solution PAS-E.
15.53 MB
Outil d’inspection visuelle
L’Outil d’inspection visuelle est un outil de laboratoire qui décrit les variations de l’aspect typique des composants sanguins. Il s’adresse à tous les membres du personnel des hôpitaux amenés à manipuler des composants sanguins en vue de leur transfusion. Étant donné qu’il n’existe pas deux composants sanguins identiques, il doit être rapproché des autres protocoles et instructions de travail de rigueur aux fins de l’inspection visuelle des composants. L'outil d'inspection visuelle remplace le guide d'inspection visuelle.
Pour d’autres renseignements sur les plaquettes mélangées à teneur réduite en agents pathogènes, vous pouvez également consulter le site Web du RROCS (Réseau régional ontarien de coordination du sang) afin de visualiser ou de télécharger les ressources élaborées par la Dre Jeannie Callum, directrice de la médecine transfusionnelle au Kingston Health Sciences Centre et chercheuse associée à la Société canadienne du sang.
Crédits de développement professionnel continu
Les associés et les professionnels de la santé qui participent au Programme de maintien du certificat du Collège royal des médecins et chirurgiens du Canada peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue comme activité de développement professionnel continu au titre de la Section 2 — Apprentissage individuel. Ces personnes peuvent réclamer 0,5 crédit par heure de lecture, jusqu’à hauteur de 30 crédits par année.
Les technologistes médicaux qui participent au Programme d’enrichissement professionnel (PEP) de la Société canadienne de science de laboratoire médical peuvent demander que la lecture du Guide de la pratique transfusionnelle soit reconnue en tant qu’activité non vérifiée
Remerciements
Les auteurs remercient Michelle Zeller, M.D., FRCPC, MHPE, DRCPSC, Anita Howell, B. Sc, technologiste médicale, Ken McTaggart, M. Sc, P. Eng, Peter Schubert, Ph. D., et Baia Lasky, M.D. pour la révision du présent chapitre.
Suggestion de citation
Blais-Normandin I, Tordon B, Anani W, Ning S. « Plaquettes à teneur réduite en agents pathogènes », dans Khandelwal A, Abe T (dir.). Guide de la pratique transfusionnelle, [Internet]. Ottawa, Société canadienne du sang. 2022 [cité le AAAA MM JJ]. Chapitre 19. Disponible sur le Web : https://developpementprofessionnel.sang.ca
N’hésitez pas à nous faire part de vos questions et de vos suggestions d’amélioration concernant le Guide de la pratique transfusionnelle par le biais de notre formulaire.
Bibliographie
- O'Brien, S. Surveillance Report 2020. (Canadian Blood Services, 2020).
- Ciaravi, V., McCullough, T. & Dayan, A.D. Pharmacokinetic and toxicology assessment of INTERCEPT (S-59 and UVA treated) platelets. Hum Exp Toxicol 20, 533-550 (2001).
- Canadian Blood Services. Circular of information for the use of human blood components - pathogen reduced platelet concentrates. (Canadian Blood Services, Ottawa, 2022).
- McDonald, C.P. Interventions Implemented to Reduce the Risk of Transmission of Bacteria by Transfusion in the English National Blood Service. Transfusion medicine and hemotherapy : offizielles Organ der Deutschen Gesellschaft fur Transfusionsmedizin und Immunhamatologie 38, 255-258 (2011).
- Ramirez-Arcos, S., Evans, S., McIntyre, T., et al. Extension of platelet shelf life with an improved bacterial testing algorithm. Transfusion 60, 2918-2928 (2020).
- Dodd, R.Y. Bacterial contamination and transfusion safety: experience in the United States. Transfus Clin Biol 10, 6-9 (2003).
- Cerus Corporation. INTERCEPT Blood System for Platelets and Plasma Pathogen Reduction System. (2021).
- Salunkhe, V., van der Meer, P.F., de Korte, D., et al. Development of blood transfusion product pathogen reduction treatments: a review of methods, current applications and demands. Transfusion and apheresis science 52, 19-34 (2015).
- Irsch, J. & Lin, L. Pathogen Inactivation of Platelet and Plasma Blood Components for Transfusion Using the INTERCEPT Blood System™. Transfusion medicine and hemotherapy : offizielles Organ der Deutschen Gesellschaft fur Transfusionsmedizin und Immunhamatologie 38, 19-31 (2011).
- Grass, J.A., Hei, D.J., Metchette, K., et al. Inactivation of Leukocytes in Platelet Concentrates by Photochemical Treatment With Psoralen Plus UVA. Blood 91, 2180-2188 (1998).
- Li, M., Irsch, J., Corash, L., et al. Is pathogen reduction an acceptable alternative to irradiation for risk mitigation of transfusion-associated graft versus host disease? Transfusion and Apheresis Science 61(2022).
- Sim, J., Tsoi, W.C., Lee, C.K., et al. Transfusion of pathogen-reduced platelet components without leukoreduction. Transfusion 59, 1953-1961 (2019).
- Ciaravino, V., Hanover, J., Lin, L., et al. Assessment of safety in neonates for transfusion of platelets and plasma prepared with amotosalen photochemical pathogen inactivation treatment by a 1-month intravenous toxicity study in neonatal rats. Transfusion 49, 985-994 (2009).
- Ciaravino, V. Preclinical safety of a nucleic acid-targeted Helinx compound: a clinical perspective. Seminars in hematology 38, 12-19 (2001).
- Webert, K.E., Cserti, C.M., Hannon, J., et al. Proceedings of a Consensus Conference: pathogen inactivation-making decisions about new technologies. Transfusion medicine reviews 22, 1-34 (2008).
- Estcourt, L.J., Malouf, R., Hopewell, S., et al. Pathogen‐reduced platelets for the prevention of bleeding. Cochrane Database of Systematic Reviews (2017).
- Knutson, F., Osselaer, J., Pierelli, L., et al. A prospective, active haemovigilance study with combined cohort analysis of 19,175 transfusions of platelet components prepared with amotosalen-UVA photochemical treatment. Vox sanguinis 109, 343-352 (2015).
- Jutzi, M., Mansouri Taleghani, B., Rueesch, M., et al. Nationwide Implementation of Pathogen Inactivation for All Platelet Concentrates in Switzerland. Transfusion Medicine and Hemotherapy 45, 151-156 (2018).
- Canadian Blood Services. Circular of information for the use of human blood components - platelets. (Canadian Blood Services, Ottawa, 2022).
- van der Meer, P.F. & de Korte, D. Platelet Additive Solutions: A Review of the Latest Developments and Their Clinical Implications. Transfusion Medicine and Hemotherapy 45, 98-102 (2018).
- Tobian, A.A., Fuller, A.K., Uglik, K., et al. The impact of platelet additive solution apheresis platelets on allergic transfusion reactions and corrected count increment (CME). Transfusion 54, 1523-1529; quiz 1522 (2014).
- Cohn, C.S., Stubbs, J., Schwartz, J., et al. A comparison of adverse reaction rates for PAS C versus plasma platelet units. Transfusion 54, 1927-1934 (2014).
- van Hout, F.M.A., van der Meer, P.F., Wiersum-Osselton, J.C., et al. Transfusion reactions after transfusion of platelets stored in PAS-B, PAS-C, or plasma: a nationwide comparison. Transfusion 58, 1021-1027 (2018).
- Mertes, P.M., Tacquard, C., Andreu, G., et al. Hypersensitivity transfusion reactions to platelet concentrate: a retrospective analysis of the French hemovigilance network. Transfusion 60, 507-512 (2020).
- Mowla, S.J., Kracalik, I.T., Sapiano, M.R.P., et al. A Comparison of Transfusion-Related Adverse Reactions Among Apheresis Platelets, Whole Blood-Derived Platelets, and Platelets Subjected to Pathogen Reduction Technology as Reported to the National Healthcare Safety Network Hemovigilance Module. Transfusion medicine reviews 35, 78-84 (2021).
- Weisberg, S.P., Shaz, B.H., Tumer, G., et al. PAS-C platelets contain less plasma protein, lower anti-A and anti-B titers, and decreased HLA antibody specificities compared to plasma platelets. Transfusion 58, 891-895 (2018).
- Andreu, G., Boudjedir, K., Muller, J.-Y., et al. Analysis of Transfusion-Related Acute Lung Injury and Possible Transfusion-Related Acute Lung Injury Reported to the French Hemovigilance Network From 2007 to 2013. Transfusion medicine reviews 32, 16-27 (2018).
- KC, G., Murugesan, M., Nayanar, S.K., et al. Comparison of ABO antibody levels in apheresis platelets suspended in platelet additive solution and plasma. Hematology, Transfusion and Cell Therapy 43, 179-184 (2021).
- Pagano, M.B., Katchatag, B.L., Khoobyari, S., et al. Evaluating safety and cost-effectiveness of platelets stored in additive solution (PAS-F) as a hemolysis risk mitigation strategy. Transfusion 59, 1246-1251 (2019).
- Mathur, A., Swamy, N., Thapa, S., et al. Adding to platelet safety and life: Platelet additive solutions. Asian J Transfus Sci 12, 136-140 (2018).
- Bastos, E.P., Castilho, L., Bub, C.B., et al. Comparison of ABO antibody titration, IgG subclasses and qualitative haemolysin test to reduce the risk of passive haemolysis associated with platelet transfusion. Transfusion medicine 30, 317-323 (2020).
- Dunbar, N.M. Does ABO and RhD matching matter for platelet transfusion? Hematology / the Education Program of the American Society of Hematology. American Society of Hematology. Education Program 2020, 512-517 (2020).
- Balbuena-Merle, R., West, F.B., Tormey, C.A., et al. Fatal acute hemolytic transfusion reaction due to anti-B from a platelet apheresis unit stored in platelet additive solution. Transfusion 59, 1911-1915 (2019).
- de Wildt-Eggen, J., Nauta, S., Schrijver, J.G., et al. Reactions and platelet increments after transfusion of platelet concentrates in plasma or an additive solution: a prospective, randomized study. Transfusion 40, 398-403 (2000).
- Kerkhoffs, J.-L.H., Eikenboom, J.C., Schipperus, M.S., et al. A multicenter randomized study of the efficacy of transfusions with platelets stored in platelet additive solution II versus plasma. Blood 108, 3210-3215 (2006).
- Tardivel, R., Vasse, J., Gaucheron, S., et al. A comparative study of the efficiency of plasma and additive solution preserved platelets. Vox sanguinis 103(2012).
- Benjamin, R.J., Braschler, T., Weingand, T., et al. Hemovigilance monitoring of platelet septic reactions with effective bacterial protection systems. Transfusion 57, 2946-2957 (2017).
- Cloutier, M., De Korte, D. & ISBT Transfusion-Transmitted Infectious Diseases Working Party, S.o.B. Residual risks of bacterial contamination for pathogen-reduced platelet components. Vox sanguinis 117, 879-886 (2022).
- Domanović, D., Ushiro-Lumb, I., Compernolle, V., et al. Pathogen reduction of blood components during outbreaks of infectious diseases in the European Union: an expert opinion from the European Centre for Disease Prevention and Control consultation meeting. Blood transfusion = Trasfusione del sangue 17, 433-448 (2019).
- Garban, F., Guyard, A., Labussière, H., et al. Comparison of the Hemostatic Efficacy of Pathogen-Reduced Platelets vs Untreated Platelets in Patients With Thrombocytopenia and Malignant Hematologic Diseases: A Randomized Clinical Trial. JAMA Oncology 4, 468-475 (2018).
- Snyder, E., McCullough, J., Slichter, S.J., et al. Clinical safety of platelets photochemically treated with amotosalen HCl and ultraviolet A light for pathogen inactivation: the SPRINT trial. Transfusion 45, 1864-1875 (2005).
- Snyder EL, W.A., Refaai MA, Cohn CS, Poisson J, Fontaine MJ, Nooka A, Uhl L, Spinella P, Corash L. The PIPER phase 4 study: pathogen inactivated platelets entering routine practice. Oral abstract presented at: The AABB Annual Meeting (Virtual), 2021; Transfusion, 2021, Vol. 61, PL4-AM21-33.
- Amsler, L. & Jutzi, M. Haemovigilance annual report 2015. (Swissmedic, Swiss Agency for Therapeutic Products, Bern, Switzerland, 2016).
- McCullough, J., Vesole, D.H., Benjamin, R.J., et al. Therapeutic efficacy and safety of platelets treated with a photochemical process for pathogen inactivation: the SPRINT Trial. Blood 104, 1534-1541 (2004).
- Cazenave, J.P., Davis, K. & Corash, L. Design of clinical trials to evaluate the efficacy of platelet transfusion: the euroSPRITE trial for components treated with Helinx technology. Seminars in hematology 38, 46-54 (2001).
- Agliastro, R., De Francisci, G., Bonaccorso., R., et al. Clinical study in pediatric hemato-oncology patients: eLicacy of pathogen inactivated buLy coat platelets versus aphaeresis platelets Transfusion 46, 117A (2006).
- DeFrancisci, G., Bonaccorso, R., Bellavia, D., et al. Clinical trial on the use of pathogen inactivated platelets, with Helinx® technology, in cardio paediatric surgery and cirrhotic patients Transfusion 44, 17A (2004).
- Delaney M, B.J., Andrew J, et al,. Multinational analysis of transfusion reactions in children transfused with pathogen inactivated platelets. Oral abstract presented at: The AABB Annual Meeting (Virtual), 2021; Transfusion, 2021, Vol. 61, PL3-AM21-33.
- Schulz, W.L., McPadden, J., Gehrie, E.A., et al. Blood Utilization and Transfusion Reactions in Pediatric Patients Transfused with Conventional or Pathogen Reduced Platelets. The Journal of pediatrics 209, 220-225 (2019).
- Schulz WL, Gokhale A., McPadden J, et al. Transfusion of pathogen reduced vs conventional platelets in pediatric patients: An assessment of platelet usage and incidence of transfusion reactions. Abstract presented at: The AABB Annual Meeting, 2018; Boston, MA: Transfusion, 2018, Vol. 58 6A-254A.
- Jimenez-Marco, T., Garcia-Recio, M. & Girona-Llobera, E. Use and safety of riboflavin and UV light-treated platelet transfusions in children over a five-year period: focusing on neonates. Transfusion 59, 3580-3588 (2019).
- Lasky, B., Nolasco, J., Graff, J., et al. Pathogen-reduced platelets in pediatric and neonatal patients: Demographics, transfusion rates, and transfusion reactions. Transfusion 61, 2869-2876 (2021).
- Cazenave, J. & Isola, H. Pathogen Inactivation of Platelets. in Platelet Transfusion Therapy (eds. Sweeney, J. & Lozano, M.) 119-176 (AABB Press, Bethesda, MD, 2013).
- Cid, J. Prevention of transfusion-associated graft-versus-host disease with pathogen-reduced platelets with amotosalen and ultraviolet A light: a review. Vox sanguinis 112, 607-613 (2017).
- Lin, L. Inactivation of cytomegalovirus in platelet concentrates using Helinx technology. Seminars in hematology 38, 27-33 (2001).
- Snyder, E., Raife, T., Lin, L., et al. Recovery and life span of 111indium-radiolabeled platelets treated with pathogen inactivation with amotosalen HCl (S-59) and ultraviolet A light. Transfusion 44, 1732-1740 (2004).
- Stolla, M. Pathogen reduction and HLA alloimmunization: more questions than answers. Transfusion 59, 1152-1155 (2019).
- Norris, P.J., Kaidarova, Z., Maiorana, E., et al. Ultraviolet light-based pathogen inactivation and alloimmunization after platelet transfusion: results from a randomized trial. Transfusion 58, 1210-1217 (2018).
- Ebbesen, F., Donneborg, M.L., Vandborg, P.K., et al. Action spectrum of phototherapy in hyperbilirubinemic neonates. Pediatric research (2021).
- Barrington KJ, S.K., Canadian Paediatric Society, Fetus and Newborn Committee. Guidelines for detection, management and prevention of hyperbilirubinemia in term and late preterm newborn infants (35 or more weeks' gestation) - Summary. Paediatr Child Health 12, 401-418 (2007).
- Cerus. INTERCEPT® Blood System for Platelets - Package Insert – Large Volume (LV) Processing Set. (Cerus Corporation, Concord, CA, 2021).
- Amato, M., Schennach, H., Astl, M., et al. Impact of platelet pathogen inactivation on blood component utilization and patient safety in a large Austrian Regional Medical Centre. Vox sanguinis 112, 47-55 (2017).