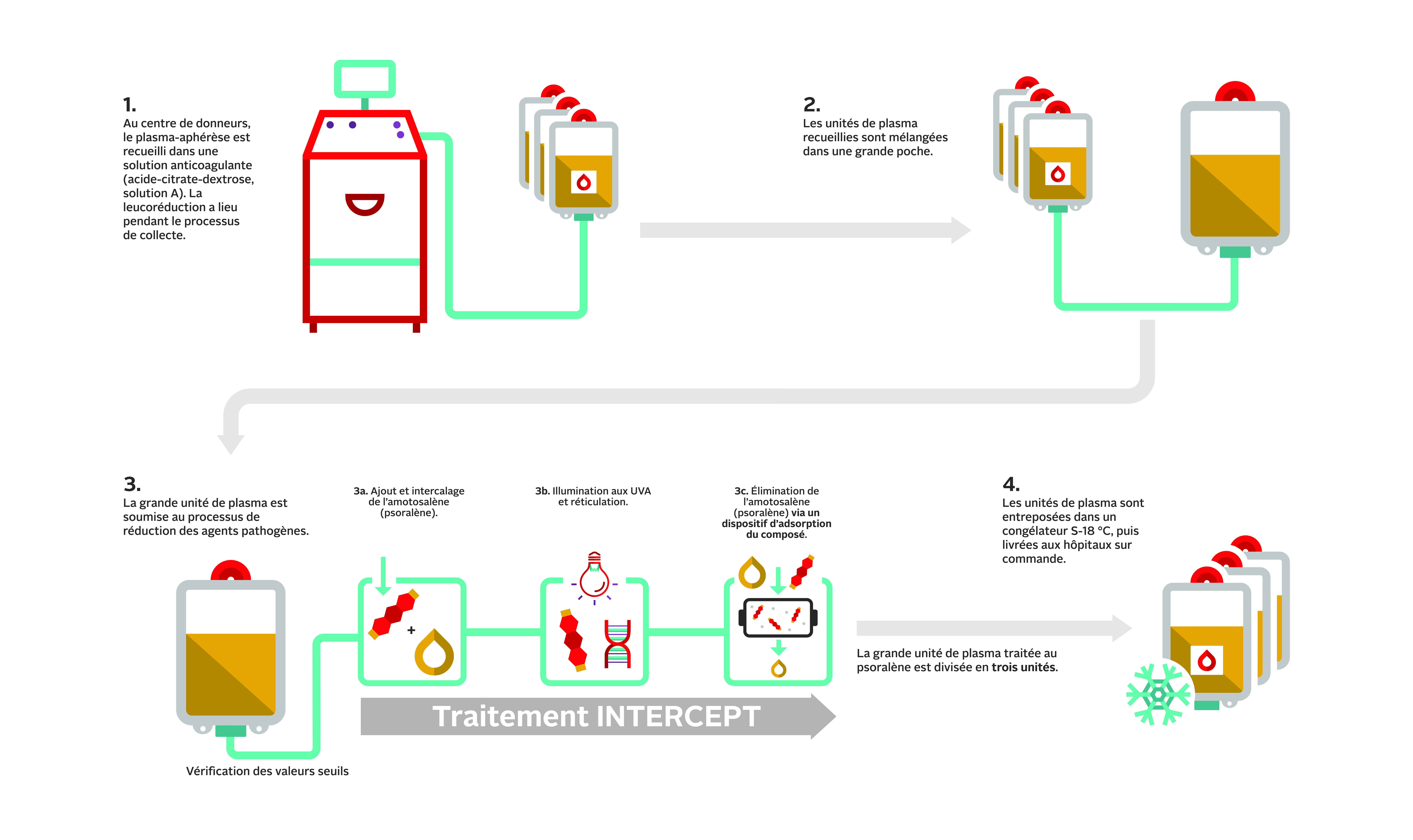
15. Comment le plasma-aphérèse traité au psoralène est-il administré?
La dose de plasma-aphérèse congelé traité au psoralène à administrer dépend de la situation clinique et de la taille du receveur. La posologie la plus courante est de 10 à 15 ml par kilogramme de poids corporel.
Des tests de coagulation en série peuvent être utiles pour déterminer la dose. Un dispositif de transfusion standard doté d’un filtre de 170 à 260 microns ou d’un filtre d’efficacité équivalente approuvé par Santé Canada doit être utilisé à cette fin.
Aucun médicament ni aucune solution ne doit être ajouté au sang ou au composant sanguin ni perfusé par la même tubulure, à moins que la solution ait été approuvée à cette fin par Santé Canada ou qu’il y ait de la documentation indiquant que l’ajout de la solution au composant sanguin en question est sûr. Veuillez consulter la circulaire d’information sur les composants pour en savoir plus.
Le débit de transfusion dépend de facteurs cliniques. Pour en savoir plus, consultez le Guide de la pratique transfusionnelle. La transfusion doit, dans tous les cas, être réalisée dans les 4 heures suivant le retrait du produit de son lieu de conservation. Le receveur doit être en observation durant la transfusion, selon les directives de l’hôpital, et doit notamment faire l’objet d’une étroite surveillance pendant les 15 premières minutes.
16. Quelles sont les indications relatives au plasma-aphérèse traité au psoralène?
Le plasma-aphérèse congelé traité au psoralène a les mêmes indications que le plasma frais et peut être indiqué dans les cas suivants :
- patients exigeant le remplacement de plusieurs facteurs de coagulation en raison de saignements ou d’un acte médical invasif présentant un risque hémorragique élevé;
- patients recevant une transfusion massive et présentant des anomalies de la coagulation cliniquement significatives;
- patients sous warfarine ayant des saignements ou devant subir un acte médical invasif présentant un risque hémorragique élevé avant que la vitamine K ne contrecarre l’effet de la warfarine; ou dans le cas où un concentré de complexe prothrombique n’est pas disponible ou est contre-indiqué;5, 6
- patients présentant un déficit en certains facteurs de coagulation ou en protéines plasmatiques rares pour lequel il n’existe pas de meilleur traitement;
- nouveau-nés devant faire l’objet d’une exsanguino-transfusion avec du sang total reconstitué;
- patients souffrant d’un purpura thrombopénique thrombotique (PTT) ou d’un syndrome hémolytique urémique pour lequel un échange plasmatique s’impose.
17. Quelles sont les contre-indications relatives à l’utilisation du plasma-aphérèse traité au psoralène?
La transfusion de composants plasmatiques à des patients ayant une anaphylaxie connue à ces composants doit être effectuée sous supervision médicale. Il est recommandé de transfuser du plasma dépourvu d’IgA aux patients ayant des anticorps anti-IgA.
Les composants plasmatiques sont contre-indiqués en cas d’hypovolémie.
Le plasma-aphérèse congelé traité par psoralène ne doit pas être administré aux :
- patients ayant des antécédents d’hypersensibilité à l’amotosalène ou à tout autre psoralène;
- nouveau-nés subissant une photothérapie à l’aide d’un appareil émettant un rayonnement d’une longueur d’onde inférieure à 425 nm et/ou présentant une longueur d’onde d’émission minimale inférieure à 375 nm, en raison du risque d’érythème qui pourrait résulter de l’interaction entre la lumière ultraviolette et l’amotosalène.
18. Comment les réactions indésirables présumées au plasma-aphérèse traité au psoralène doivent-elles être gérées?
La gestion des réactions indésirables présumées doit se conformer aux directives concernant les réactions indésirables associées aux composants sanguins conventionnels. Pour plus de détails, veuillez consulter la publication intitulée Déclaration des réactions transfusionnelles indésirables.
Les transfusions sanguines peuvent provoquer des réactions indésirables de différents degrés de gravité : légères et sans séquelles pour les moins graves, et potentiellement mortelles pour les plus graves. Lorsqu’une réaction survient durant la transfusion, il convient de l’évaluer pour savoir si la transfusion peut être poursuivie ou reprise sans risque. Toute réaction susceptible d’être liée à la transfusion, qu’elle soit survenue pendant ou après l’acte transfusionnel, doit être déclarée au service transfusionnel local et, si nécessaire, au réseau d’hémovigilance hospitalier ou régional. En vertu du Règlement sur le sang de Santé Canada, les réactions indésirables découlant du procédé de fabrication (associés à la qualité des composants sanguins, par exemple) doivent être signalées à la Société canadienne du sang.7-10
La déclaration des cas soupçonnés de transmission du VIH, VHC, HTLV, VHB, VNO et autres infections liées à la transfusion est décrite au Chapitre 1 du Guide de la pratique transfusionnelle et dans la publication intitulée Déclaration des réactions transfusionnelles indésirables.
19. Quels sont les avantages du recours au plasma à teneur réduite en agents pathogènes?
Le plasma inactivé contre les agents pathogènes offre une protection supplémentaire contre les contaminants bactériens (Gram positifs et Gram négatifs), les virus (enveloppés et non enveloppés), les parasites protozoaires et les globules blancs (leucocytes).
Outre la réduction du risque de transmission d’agents pathogènes, l’utilisation de technologies de réduction des agents pathogènes, telles que le plasma lavé au détergent, diminue également les autres réactions transfusionnelles indésirables. Il s’agit notamment d’une réduction des réactions allergiques et des réactions transfusionnelles fébriles non hémolytiques; toutefois, ces réductions peuvent refléter le mélange du plasma et la dilution subséquente des allergènes ou réactifs potentiels plutôt que le processus de réduction des agents pathogènes.
20. Le plasma-aphérèse traité au psoralène peut-il servir à traiter les patients néonatals et pédiatriques?
Les données disponibles sur l’utilisation du plasma à teneur réduite en agents pathogènes pour la transfusion chez les patients pédiatriques et néonatals sont limitées. Cependant, les données d’hémovigilance disponibles suggèrent que le produit est sûr et bien toléré dans cette population.
Les études préliminaires menées sur des animaux avec du plasma à teneur réduite en agents pathogènes n’ont rapporté aucun effet indésirable lié à la transfusion chez des rats nouveau-nés. Plus précisément, aucun effet indésirable lié à l’amotosalène n’a été observé chez les rats nouveau-nés, malgré une exposition à des concentrations d’amotosalène jusqu’à 48 fois supérieures à l’exposition standard chez les patients adultes.11
Les essais cliniques chez des humains ont également rapporté des réactions indésirables inexistantes ou de faible intensité chez les populations pédiatriques et néonatales. Un essai clinique ouvert mené en Belgique et en France a rapporté que la transfusion de plasma à teneur réduite en agents pathogènes était bien tolérée dans le cadre d’une utilisation clinique courante chez les enfants et les nourrissons.12 L’étude a évalué 160 enfants (âgés de 1 à 18 ans) et 188 nourrissons (âgés de moins d’un an) entre 2007 et 2011, soit 11 % du total des patients hématologiques, médicaux et chirurgicaux mixtes participant à l’étude (n = 3 232). Les résultats pour les patients pédiatriques n’ont pas été rapportés séparément de ceux des patients adultes, mais des réactions transfusionnelles indésirables ont été rapportées dans 0,11 % (8 sur 7483) des transfusions, dont cinq de grade 1 et trois réactions indésirables graves; toutes les réactions indésirables sont survenues chez des patients adultes dans cette étude. Aucune réaction TRALI n’a été rapportée.
Une autre étude d’hémovigilance évaluant le profil d’innocuité des plaquettes à teneur réduite en agents pathogènes et du plasma à teneur réduite en agents pathogènes dans 11 pays sur une période de 8 ans a signalé des réactions transfusionnelles peu fréquentes chez les patients (0,4 % des transfusions). L’étude a évalué 440 nourrissons (âgés de moins d’un an) et 355 enfants (âgés de 1 à 18 ans); les données pédiatriques n’ont pas été rapportées séparément de celles des patients adultes. Une étude d’hémovigilance post-commercialisation portant sur 3 179 transfusions de plasma et de plaquettes à teneur réduite en agents pathogènes dans 11 pays a montré que ces composants étaient bien tolérés par la population pédiatrique, seules des réactions transfusionnelles légères ayant été rapportées. L’échantillon comprenait 540 enfants (âgés de 1 à 18 ans) et 499 nourrissons (âgés de moins d’un an) présentant des indications cliniques mixtes pour une transfusion, notamment médicales (45 %), hématologiques-oncologiques (34 %) et chirurgicales (20 %). Trois des 795 patients pédiatriques ont présenté une réaction transfusionnelle. Les symptômes étaient caractérisés par une éruption cutanée (n = 2), une urticaire (n = 1) et des frissons (n = 1) sans conséquences graves, sans TRALI ni septicémie associée à la transfusion.13
Du point de vue de l’hémostase, une étude ouverte unilatérale sur le plasma à teneur réduite en agents pathogènes a rapporté une bonne cinétique des facteurs de coagulation post-transfusionnelle et une efficacité hémostatique lorsqu’il est utilisé à des fins prophylactiques et thérapeutiques. L’étude a porté sur 34 patients ayant reçu 107 transfusions; une partie des participants étaient des enfants (âgés de 3 à 77 ans), mais les données relatives aux enfants n’ont pas été rapportées séparément de celles des adultes.14
À l’heure actuelle, les données sur l’innocuité du plasma-aphérèse congelé traité au psoralène utilisé pour la transfusion intra-utérine sont limitées.15
21. Quelle dose de plasma-aphérèse traité au psoralène faut-il prescrire?
La dose de plasma-aphérèse congelé traité au psoralène à administrer dépend de la situation clinique et de la taille du receveur. La posologie la plus courante est de 10 à 15 ml par kilogramme de poids corporel. Des tests de coagulation en série peuvent être utiles pour déterminer la dose.
22. Quels sont les niveaux de facteurs entre le plasma-aphérèse congelé traité au psoralène, le plasma traité au solvant-détergent et le plasma congelé non traité?
Tableau 2. Comparaison de la qualité in vitro du plasma 0 jour après décongélation selon les types de plasma
| Paramètre |
Multiplasma non O non traité
(n = 15) †
|
Multiplasma non O traité par INTERCEPT
(n = 33) †‡ |
Octaplasma
(n = 12) § |
Plage de référence clinique en laboratoire, 95 % CI|| |
|---|
| |
Moyenne |
Écart type |
Min |
Max |
Moyenne |
Écart type |
Min |
Max |
Moyenne |
Min |
Max |
|---|
| Facteur VIII (UI/ml) ¶ |
1,36 |
0,31 |
0,67 |
1,88 |
0,83 |
0,18 |
0,37 |
1,15 |
1,08** |
0,80 |
1,30 |
0,50-1,49 |
|---|
| Facteur VII (UI/ml) |
1,13 |
0,26 |
0,69 |
1,67 |
0,87 |
0,19 |
0,38 |
1,27 |
1,08 |
0,90 |
1,17 |
0,45-1,33 |
|---|
| Facteur V (UI/ml) |
0,94 |
0,11 |
0,71 |
1,17 |
1,01 |
0,21 |
0,63 |
1,36 |
0,78 |
0,75 |
0,84 |
0,66-1,02 |
|---|
| Fibrinogène (en g/l) |
3,09 |
0,51 |
2,22 |
3,76 |
2,53 |
0,56 |
1,82 |
3,68 |
2,50 |
2,40 |
2,60 |
1,70-4,10 |
|---|
| Temps de prothrombine |
14,00 |
0,50 |
13,20 |
14,80 |
15,10 |
0,8 |
13,90 |
17,50 |
Aucune donnée |
10,40-12,30 |
|---|
| Protéine S (UI/ml) |
1,02 |
0,18 |
0,66 |
1,30 |
0,83 |
0,15 |
0,55 |
1,22 |
0,64 |
0,55 |
0,71 |
0,55-1,43 |
|---|
| Facteur alpha-2-antiplasmine (IU/ml) |
1,20 |
0,14 |
1,01 |
1,53 |
1,02 |
0,12 |
0,81 |
1,29 |
0,23 |
0,20 |
0,27 |
0,68-1,26 |
|---|
| Antigène ADAMTS-13 (IU/ml) |
0,78 |
0,18 |
0,54 |
1,07 |
0,93 |
0,12 |
0,67 |
1,24 |
1,01 ± 0,08
(moyenne ± ET) |
40%–130%# |
|---|
† L’alpha2-antiplasmine et l’ADAMTS-13 ont été déterminés à l’aide de trousses conçues à des fins de recherche. Les autres paramètres ont été testés sur un analyseur de coagulation Stago. Toutes les méthodes sont conçues pour des échantillons de diagnostic clinique; cependant, nous les utilisons « hors indication » pour mesurer les paramètres liés à la coagulation dans les composants plasmatiques (n = 33 pour tous les paramètres).
‡ Les données ont été recueillies à partir des données sur le développement de la Société canadienne du sang.
§Tous les paramètres sont tirés de la monographie du produit (n = 12),16 à l’exception de l’ADAMTS-13 (n = 18) tiré de https://www.octaplasma.ca/standardization-of-plasma-protein-levels-in-octaplasma/.
|| Il n’existe actuellement aucun critère d’acceptation défini par la norme CSAZ902-257 spécifiquement pour le plasma à teneur réduite en agents pathogènes.
¶ Les plages de référence ont été tirées de l’étude d’Erickson et coll.17 et ont été établies à partir d’échantillons de plasma frais congelé provenant de donneurs normaux par le Machaon Diagnostic Laboratory.
# Le pourcentage d’activité et l’unité UI/ml sont directement proportionnels (c’est-à-dire que si l’activité est de 50 %, elle sera de 0,5 UI/ml).
** Données de Heger et coll.18
23. Le plasma-aphérèse traité au psoralène peut-il être utilisé pour d’autres options de traitements?
Ne pas utiliser de plasma-aphérèse congelé traité au psoralène s’il est possible de mieux corriger la coagulopathie par un traitement spécifique comme l’administration de vitamine K ou le remplacement d’un facteur de coagulation particulier. Par exemple, le remplacement des facteurs de coagulation dépendants de la vitamine K (soit les facteurs II, VII, IX et X) peut être obtenu à l’aide de concentrés de complexe prothrombique.
Des produits recombinants, des produits de fractionnement viro-inactivés et la 1-diamine 8 D-arginine-vasopressine sont des traitements de première ligne plus appropriés contre l’hémophilie A, l’hémophilie B et la maladie de von Willebrand. Il existe également sur le marché des concentrés viro-inactivés pour le remplacement du fibrinogène et du facteur XIII. Certains produits ne peuvent être obtenus que dans le cadre du Programme d’accès spécial de Santé Canada.
Le plasma traité au solvant-détergent est une alternative au plasma-aphérèse congelé traité au psoralène.